Hess-törvény és annak következményei
C (grafit) + O2 (g) = CO2 (g) # 916; H.
Jelentenek vázlata látható:
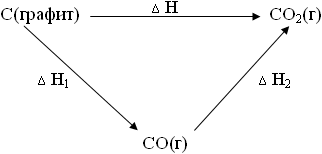
Ez azt jelenti, hogy ha mind a három folyamat Tiskh kielégíteni a keresletet. = Tkonechn. és Riskh. = Rkonechn .. akkor függetlenül attól, hogy a grafit elégetik, azonnal, vagy az első CO2 CO, majd CO CO2. hőhatás ugyanaz lesz.
Következményei a törvény Hess:
- Ha eredményeként az egymást követő kémiai reakciók a rendszer eléri állapotában teljesen egybeesik a kiindulási (forgó folyamat), az összeget a hőhatás E reakciók nulla lesz.
- A termikus hatás reakciók (# 916 ;. Nh.r) összegével egyenlő a futamok képződési (vagy # 916; Nobre. ) Véges anyagok (# 916; Nkonech in-ben) mínusz az összege az melegíti képződésének a kiindulási anyagok (# 916; Csökkenő in-in) ..:
Izobár izotermikusnak potenciál (Gibbs energia)
Ebből következik a korábban úgy vélték, hogy a kémiai folyamatok ugyanakkor van két tendencia:
1. Aspiration részecskék össze bonyolultabb, ami csökkenti a entalpia.
2. A vágy, hogy kioldja részecskék, növeli a betegség, ami növeli az entrópia.
A kumulatív hatása E két ellentétes tendencia a folyamatok fordulnak elő állandó hőmérsékleten és állandó nyomás, a változás tükrözi izobár-izoterm (vagy röviden - izobár) Kapacitás # 916; G:
# 916; G = # 916; H - T # 916; S,
ahol # 916; H - eptalpii változás (hőtartalmának a rendszer) kJ / mól;
# 916; S - entrópia változása (lépéseket rendellenesség rendszerek), J / mol • K;
T - a hőmérséklet, K
Gibbs potenciált mérjük kcal / mol vagy kJ / mól.
bekövetkezett változások # 916; G jelzi az alapvető lehetősége vagy lehetetlensége a folyamat:
ha # 916; G <0, т. е. изобарный потенциал в ходе реакции уменьшается, то процесс возможен и, начавшись, он протекает самопроизвольно (спонтанно).
ha # 916; G> 0, akkor nem lehet elvégezni az eljárást ilyen körülmények között.
ha # 916; G = 0, az állam a kémiai egyensúly figyelhető meg.
Nem az egész választ. Részéről a nem!
A reakció sebessége fejezhető ki változást az anyag mennyiségét (N, abszolút értékben) egységnyi idő (t) - összehasonlítani a sebességet a mozgó test a fizika, mint egy koordináta-változás egységnyi idő: # 965; = # 916; x / # 916; t. Ez az arány nem függ a térfogata az edényt, amelyben a reakció lejátszódik, felosztják a expresszióját a reaktánsok mennyiségét (V), azaz, Megkapjuk a változás mennyisége az anyag egységnyi idő alatt egységnyi térfogatú, vagy koncentráció-változását egy anyag egységnyi idő:
ahol c = n / v - anyag koncentrációja,
Befolyásoló körülmények aránya a kémiai reakciók
1) A reakció sebessége függ a a reaktánsok természetétől. Egyszerűen fogalmazva, a különböző anyagok reagálnak különböző sebességgel. Például, a cink hevesen reagál sósavval és a vas meglehetősen lassú.
2) A reakció sebessége annál nagyobb, minél nagyobb az anyagok koncentrációjának. A nagyon hígított sav cink fog reagálni sokkal hosszabb.
3) A reakció sebessége jelentősen növeli a hőmérséklet növekedésével. Például, az üzemanyag égési kell égetni, azaz növeli a hőmérsékletet. Sok reakciók, a hőmérséklet-emelkedés a 10 ° C-növekedése kísérte az arány 2-4 alkalommal.
4) Speed heterogén reakciók növekszik a reagensek felszíne. Szárazanyag-tartalom általában megőrlik. Például, hogy a vas és a kén-porokat hevítve fog reagálni, a vas kell a formájában a kis zseton.
Figyeljük meg, hogy ebben az esetben azt jelenti, hogy az (1)! (2) egyenlet fejezi ki aránya egységnyi területen, így nem függ méretét.
5) A reakció sebessége függ a katalizátor jelenlétében vagy inhibitorok.
Katalizátorok - anyagok, amelyek felgyorsítják a kémiai reakciók, de nem költenek. Példa - gyors hidrogén-peroxid bomlását hozzáadásával a katalizátor - mangán-oxid (IV):
Mangán-oxid (IV) alján, lehet újra.
Inhibitor - egy anyag késlelteti a reakciót. Például, hogy meghosszabbítja az életet az akkumulátorok csövek és a meleg víz fűtési rendszer adunk korróziós inhibitorok. A járművek korróziós inhibitort adunk hozzá, hogy a fék, a hűtőfolyadék.
A katalizátor aktivitása csökken meredeken jelenlétében ismert anyag katalizátormérgek. Ha a katalizátort és reagáló anyagok ugyanabban a halmazállapotát, általában gáz halmazállapotú vagy folyékony, ez az úgynevezett homogén katalízis. A szerepe katalizátorok homogén katalízis gyakran jár oldatok savak, bázisok, sók d-elemek, oldószerek. Katalízis heterogén. Ha a katalizátort és reagáló szerek különböző állapotaiban aggregáció vagy elkülönült fázist alkot. A szerepe katalizátorok ebben az esetben jár többnyire szilárd, tipikusan d-elemek vagy ezek vegyületei. Katalizátorok nem változtatják meg az entalpia és Gibbs a reakció, és nem befolyásolja a helyzet a kémiai egyensúlyi reakciók. Katalizátorok csak növeli egyaránt felgyorsítja forward és reverz reakciókat.
Megkülönböztetése homogén és heterogén rendszerek. Homogénnek nevezzük álló rendszer egyik fázis, heterogén - egy olyan rendszer, amely több fázisban. Fázis az a része, a rendszer, elkülönül a többi részei a felület, amelyen keresztül a tulajdonságok változik hirtelen.
Kémiai egyensúlyi homogén rendszerek
Abban az esetben, az egyenlő entalpia és entrópia tényezők # 916; T # H = 916; S # 916; G = 0, ami egy termodinamikai állapota kémiai egyensúly. Kémiai egyensúly dinamikus. A reakció sebessége (a részecskék száma generált egységnyi idő per egységnyi térfogatban) az előre irányban megegyezik a sebességgel az ellenkező irányba a reakciót. Ezen a ponton a koncentráció a kiindulási anyagok és a reakciótermékek nem változik az idő múlásával, és az úgynevezett egyensúlyi koncentrációja. Ezek jelzik az anyag zárójelben.