vizsgálat
Számítsuk ki a forráspontja 5% -os oldatából naftalin S10H8v benzol. Forráspont 80.2ºS benzolt. Ebulioskopicheskaya ő állandó 2.57ºS.
Szerint a Raoult-törvény növeli a forráspontja oldatot képest oldószer forráspontja közötti hőmérsékleten fejezzük ki a következő egyenlettel:
? T - változik a forráspont az oldat, ° C
By - ebulioskopicheskaya állandó ° C;
m- tömeg oldott anyag g;
M1- oldószert tömege grammban;
M - moláris tömege az oldott anyag, g
S10H8 M = 12 * 10 + 1 * 8 = 128g
A: Forráspont 5% -os oldat naftalin S10H8v 81.25ºS benzolt.
Tárgy: A hidrolízis sók.
Gidroliz- egy kémiai kölcsönhatás az oldott só ionok vízből, így a formáció slabodissotsiiruyuschih termékek (molekulák gyenge savak vagy bázisok, anionok, savas vagy bázisos sói kation) és kíséri izmeneniempHsredy.
1.Na3PO4 a sót egy erős bázis (alkáli) közegben NaOHi sav (foszforsav) H3PO4. Hidrolízise a só anionosan mert + KationNa érintkeztetjük a hidroxil-anionomOH¯ formák erős elektrolitNaOH disszociál ionokra.
Hárombázisos foszforsav képezi háromféle sói:
NaH2PO4 primordiális fosfatNa, oldható
Na2HPO4 - szekunder fosfatNa gyakorlatilag oldhatatlan
Na3PO4- tercier fosfatNa, gyakorlatilag nem oldódik.
Ebből nyilvánvaló, hogy a hidrolízis során az Na3PO4, azaz reakció előtt bekövetkezett képződését slabodissotsiiruyuschey (nehezen oldható) sók, majd másodlagos foszfát natriyaNa2HPO4.
Na3PO4 + H2O↔Na2HPO4 + NaOH
NaH2PO4 + H2O = H3PO4 + NaOH
Általában, a reakció az első szakasz, majd a hidroxil-ionokkal felhalmozódnak oh, és nem ereszt addig, amíg a végén a reakciót.
Mivel a képződött sav-só és egy erős bázis (alkáli) oldat reakció lúgos, vagyis pH> 7.
2.SolK2S, kálium-szulfid - a sót erős bázissal, és egy gyenge hidrogén-fluorid kislotyH2S. Hidrolízise a só megy két szakaszban, mivel hydrosulphuric sav disavat anionosan. K2Spri sót vízben oldjuk, disszociál egy kation K + és a szulfid anionS¯². A kation K + nem köti a hidroxil-anion, mint ezáltal egy erős elektrolitKOH amely azonnal disszociál ionokra és szulfid anionS¯² gyenge sav kötődik a hidroxil-csoport vegyület malodissotsiiruyuschee.
Hidrolízis következik be az első szakaszban, hogy egy erősen lúgos kémhatású, pH> 7.
3.CuSO4, réz-szulfát - sót valamely erős sav és egy gyenge bázis mnogokislotnogo. Cu (OH) 2. Hidrolízise a só megy alkotják a fő soliCuOH + kationok.
CuSO 4 + H2O↔ (CuOH) 2SO4 + H2SO4
2-fokozatú reakció nem megy miatt a feleslegben lévő hidrogén képződik erős kénsavval ionok. Közeg savas reakció, pH =<7.
Téma: Redox reakciók.
A reakciókat kifejezve áramkörök
Hogy az elektronikus egyenlet. Gondoskodjon a együtthatók az egyenlet a reakció. Mindegyik reakciónál, meghatározza, hogy milyen az anyag egy oxidálószer, amely - redukálószer; amely az anyag oxidálódik, ami - helyreáll.
A reakciókat kíséri változás az oxidáció mértékét az atomok tartalmazó reagenseket úgynevezett redox. Ebben az esetben egy anyag oxidálódik, a másik helyreáll, kapcsolt folyamat.
Under oxidációs megérteni kondicionált töltés atom amelynek kiszámítása a feltételezéssel, hogy a molekula az csak ionok.
Az oxidációs állapota - ez kondicionált díjat szerezné atom elem, feltételezve, hogy nem kapta meg, vagy hogy egy bizonyos mennyiségű elektront.
Oxidáció - a folyamat visszarúgás elektronok atom, molekula vagy ion.
Recovery - elektron kapcsolódási folyamat atom, molekula vagy ion.
Adományoz egy elektron - redukálószer maga oxidálódik,
Fogadása elektronikus oxidálószert magát, miközben talpra.
1.Snachala ebben a rendszerben az egyenletek határozzák meg az oxidáció mértékét az atomok a bal és jobb oldalon az egyenlet, majd elemzi, hogyan kell változtatni az oxidációs állapotban minden egyes atom vesz részt a redox folyamatban, elektronikus formában az egyenletet, és módszer az elektronikus mérleg egyenletek elválás együtthatók.
H2S + Cl2 + H2O → H2SO4 + HCI
A mértéke kén oxidációs soedineniiH2S SB (-2) -rövid szénláncú,
a vegyület H2SO4 (+6) -vysshaya. A hidrogén-szulfid egy redukálószer maga oxidálódik.
Az oxidáció mértéke a klór szabad klór - (0) - egy közbenső hidrogén-klorid
(-1) -rövid szénláncú. A klór egy oxidálószer, visszanyerve önmagát.
Írunk az elektronikus egyenlet:
Restaurátor s² -8e = S + 6protsess oxidációs / 8 = 1 K
Oxidálószer 2CI ° + 2e = 2Cl¯¹ helyreállítási folyamat / 2 K = 4
A teljes száma elektronok által kiadott egy redukáló-8 ad egy mól hidrogén-szulfid. Ugyanebben az elektronok száma meg kell tennie oxidálószer: 1 mól klór elfogadja 2 elektront, törvény által multiplicitás 8 4 mól elektronok lesz klóratom. Azt hogy az együttható 1 együttható molekula H2Si 4 előtt molekuloyCl2. Mi megszervezzük a fennmaradó együtthatók ezekkel összhangban. Az egyenlet:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Így a bemutatott reakciók:
-Cl2- oxidáló visszanyeri önmagát; 4 molekulát tartalmazó 8 klóratomok, hogy 8 * 1 = 8 elektronokat.
ad 1 * 8 = 8 elektronokat.
2. Reakcióegyenlet:
K2Cr2O7 + H2S + H2SO4 → S + Cr2 (SO4) 3 + K2SO4 + H2O
Sajtolt oxidációs állapota
K2Cr2O7 + H2S + H2SO4 → S + Cr2 (SO4) 3 + K2SO4 + H2O
krómatom változik a oxidációs foka 3-6, azaz elektron, és ezért 3 egy oxidálószer.
egy kénatom, egy molekula kénsavat nem változik az oxidáció mértékét jelenti során a redox nem vesz részt. Kénatom, egy része a hidrogén-szulfid-molekulák megváltoztatja az oxidáció mértékét (-2) a (0), azaz veszít elektronokat és egy redukálószer. Elektronikus egyenletek formájában:
Restaurátor s² -8e = S + 6protsess oxidációs / 8
Oxidálószer Cr + 6 + 3e = Cr + 3protsess helyreállítási / 3
Tekintettel arra, hogy a molekulában tartalmaznak 2 K2Cr2O7 atomaCr, a teljes elektronok száma elfogadott molekuloyK2Cr2O7 6, az elektronikus egyenlet formájában:
Restaurátor s² -8e = S + 6protsess oxidációs / 8
Oxidálószer 2CR + 6 + 6e = 2CR + 3protsess helyreállítási / 6
A legkisebb többszöröse a 8-as és 6-24.
A koefficiens egy molekula atom alkotja s² egyenlő 24/8 = 3
A koefficiens egy molekula atomok tartalmazó Cr + 24/6 = 4 6raven
Mi lepecsételt ezeket a tényezőket, és válassza mások.
reakcióegyenlet formáját ölti:
4K2Cr2O7 + 3H2S + 16H2SO4 → 3S + 4Cr2 (SO4) 3 + 4K2SO4 + 28H2O
Így a bemutatott reakciók:
így 3 * 8 = 24 elektronok.
Tárgy: Az elektróda potenciál és elektromotoros erő.
Tedd diagramok két elektrokémiai cellát, amelyek közül az egyik lenne réz katód, míg a másik - az anód.
Írni minden egyes ilyen elemek az egyenlet e reakciók végbemenetelét a katód és az anód.
Az elektróda potenciál - jelentése kettős elektromos rétegű, azzal jellemezve potenciális ugrást, amely képződik a fém-folyadék határfelület.
A mechanizmus annak előfordulása az, hogy: merítjük a fémlemezt a fémkationok vízben felszínén hidratált poláros vízmolekulák és transzformáljuk folyadék. Az elektronok maradó fém felületi réteg kapcsolódik a negatív töltés. Egy közötti elektrosztatikus vonzás a folyadék esett a hidratált kationok és a fém felületén. mobil egyensúlyi állapot jön létre a rendszerben:
+ MH2O↔ Me Me (H2O)
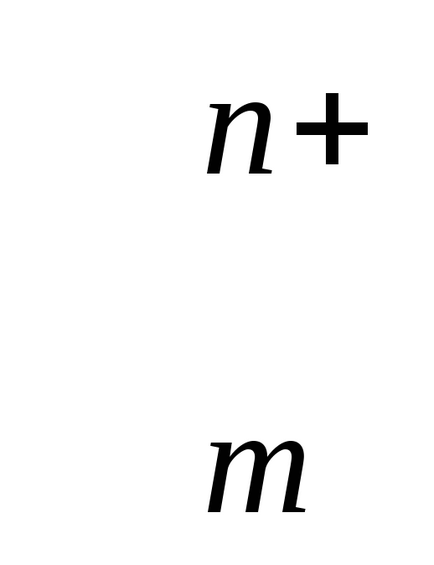
n-elektronok száma a folyamatban részt vevő.
Standardpotenciál - az elektród potenciál, amely akkor keletkezik, amikor a fém oldatba merítjük saját ionok koncentrációjának (avagy aktivitásától) 1 mol / l, mérve összehasonlítva egy standard hidrogén elektród.
A potenciális standard hidrogén elektród 25 ° C-on hagyományosan nullának (E ° = 0; ΔG ° = 0).
Ha fémek vannak elhelyezve egy sorban növekvő azok elektródpotenciálok E °. sorozatát kapjunk standardpotenciál iliryad hangsúlyozza.
A kisebb érték a standardpotenciál E °, annál nagyobb a redukáló tulajdonságai aktív fém, mint egy egyszerű anyag és a kisebb oxidativ kapacitása mutatnak annak ionok, és fordítva.
Emlékezzünk, hogy az anódon:
Ez kiterjeszti oxidációs, elektron impakt folyamat atom, molekula vagy ion. Adományoz egy elektron - redukálószer maga oxidálódik,
Recovery történik, az elektron kapcsolódási folyamat atom, molekula vagy ion.
Fogadása elektronikus oxidálószert magát, miközben talpra.
Megoldásokat adatainak felhasználásával számos feszültségek és a fenti szabályokat.
Fémek, minimális számszerű értéke E °, azaz a található, az elektrokémiai sorban fenti réz, mutatnak nagy csökkenés tulajdonságokkal, mint egy egyszerű anyag, azaz a Me ° szolgál majd az anód és adja fel az elektronokat. Ebben az esetben a katód réz.
Úgy döntünk, fémet, mint a bizmut.
A legkevésbé szeres aivadási faktor, az egyenlet:
2 Bi + 6e + 3Si + 2 + 6e = 2BI + 3 ° vagy + 3Su
2 Bi + 3Si + 2 = 2BI + + 3 ° 3Su
Most vegyük azt az esetet, amikor a réz fog szolgálni az anód. Mi választjuk fém alatt elhelyezett réz az elektrokémiai sorban, mint például az ezüst.
Réz (egyszerű anyag), amelynek kisebb a szám E °, akkor mutatnak redukáló tulajdonságai, vagyis a elektrondonor és szolgálnak az anód.
A teljes reakció egyenlete
Cu ° - 2e + 2Ag + + 2e = Cu 2 + + 2Ag °
Hogy az elektronikus egyenlete folyamatok játszódnak le az grafitelektródával elektrolízise során megolvad és víz rastvorovNaCliKOH.
Hány liter (STP) gázt van kiemelve az anód elektrolízisével kálium-hidroxid, ha végrehajtott elektrolízis 30 percen át egy áram 0,5 A?
Az oldat vagy olvadék kationok és anionok mozgassa kaotikusan. Ha ez a közeg kihagyja semleges (grafit) elektródák, át állandó áramerősségen, a mozgás a kationok és anionok, illetve irányított mozgása veszi a jeleket.
A katódon kationok felvesznek elektronokat, kinyerjük, az anódnál anionok adományozni elektronokat oxidált.
Így, elektrolízis az úgynevezett redox folyamat, amely akkor az elektródok alatt átfolyó villamos áram segítségével a elektrolit oldat vagy olvadék.
elektrolízis oldat és olvadék eljárás különbözik, hogy az elektrolízis oldat elektrolízisével részt H2O vízmolekulák vesznek részt a elektrolízise olvadékot csak kationok és anionok anyag.
1. Írja az elektrolízis egyenlet nátrium-klorid oldattal.
A katódon: 2H2O + 2e = H2 + 2OH
Az anódon: 2CL -2E = Cl2 (gáz)
A teljes ionos formában:
2H2O + 2CI elektrolizH2 + Cl2 + 2 ON
A teljes molekuláris formájában:
+ 2 H2O + Cl2 + 2NaClelektrolizH2 2 ON
A katódon hidrogén szabadul fel az anódon - klór-,
és felhalmozódik NaOH (Na ++ OH) oldatban
2. Írja az elektrolízis egyenlet KOH-oldatot
A katódon: 2H2O + 2e = H2 + 2OH / 2
Az anódon: 4ON¯ -4 E = 2H2O + O2 (gáz) / 1
Összesen. 4H2O + 4e + 4ON¯ -4e¯ = 2H2 + 4OH-t + 2H2O + O2 (gáz)
2 N2Oelektroliz 2H2 (gáz) + O2 (gáz)
A katódon hidrogén szabadul fel az anódon -kislorod,
és felhalmozódik KOH-oldatot (K ++ OH)
3. Írja olvad NaCl elektrolízis egyenlet.
A katód. Na + + E = Na (met) / 2
Az anód. 2 cl -2E = Cl2 (gáz) / 1
2 Na + 2 + E + 2CL -2e¯elektroliz2Na (met) + Cl2 (gáz)
4. Írjuk be az elektrolízis egyenlet KOH olvad.
A katód. K + 1 + E = K (met) / 4
Az anód. 4ON¯ - E = 2H2O + 2O + 4e
4ON¯ - E = 2H2O + O2 + 4e / 1
4K + 4ON¯ = K (met) + 2H2O + O2
KOH elektrolízis K (met) + 2H2O + O2
Kiszámolni, hogy hány liter (STP) gázt kiemelve az anód elektrolízissel kálium-hidroxid, ha végrehajtott elektrolízis 30 percig áram 0,5 A, Faraday-törvény alkalmazandó.
Abban az anód, az oxigén, a által meghatározott összeg képlettel kifejező törvénye Faraday
m = me * I * t / 96500, ahol:
m- tömeg anyagok, oxidált vagy redukált elektródon;
me - ekvivalens moláris anyag tömege; meO2 = 8d
I- áramerősség; I = 0.5A
t- DURATION elektrolízis, szek, t = 30 * 60 = 1800sek;
m = me * I * T / 96500 = 8 * 0,5 * 30 * 60/96500 = 0.0746g
Azon a tényen alapul, hogy 1 g-mól oxigén (32g) foglal térfogatban 22,4 liter (STP) a meghatározott tömegű oxigén vesz 0.0746g térfogata:
0,0746 * 22,4 / 32 = 0.052l (NU)
Válasz: ilyen körülmények között az anód van jelölve 0.052l O2.
Tárgy: A fémek korróziója.
Hogy a légköri korrózió a vas, borított egy réteg nikkel, ha a bevonat sérült? Hogy az elektronikus egyenlet katódos és anódos folyamatokat. Mi az összetétele a korróziós termékek.
A fém korrózióját - spontán áramló fém megsemmisítés folyamat eredményeként kölcsönhatás a környezet kémiai vagy elektrokémiai úton.
Amikor az elektrokémiai korrózió fordulhat elő redox reakciók, azaz szükséges két folyamat: egy anódot és egy katódot.
Elektrokémiai fém korrózió lép fel, amikor a fém vizes oldatban vagy nedves atmoszférában. Korrózió áramló nedves atmoszférában, az úgynevezett légköri. Amikor ez oxidálószer jelentése oxigénatom.
Anód megsemmisítése folyamat (oxidáció) a fém alábbi egyenlet fejezi ki:
A katód helyreállítási folyamat oxigén molekulák vízben oldjuk:
Vizsgálni, hogy a légköri korróziónak vas bevétel károsodott nikkel bevonattal.
Határozza meg a helyzetét a galvanikus párok kialakítva az elektrokémiai sorban.
Vegye figyelembe a szabály, hogy a fém, amelynek kisebb számértéke E °, azaz a elhelyezve egy sorban fölött a feszültség nagy lesz csökkentése tulajdonságokkal, mint egy egyszerű anyag, azaz a Me ° ez szolgál majd az anód és a elektronküldő
Ezért, ebben a kiviteli alakban, a vas, amelynek egy kisebb számot az elektrokémiai sorban, mint a nikkel, az oxidációs:
Fe ° - 2E = Fe + 2 - az anódon;
1 / 2O2 + H2O + 2e = OH 2 ¯ - a katódon.
Továbbá, vas kationokkal kapcsolódni egy hidroxil-csoporttal képeznek oldhatatlan (oldhatósága táblázatos) Fe (OH) 2