Biológia és Kémia
Hidrolízise 2.15, mint a csere folyamat
Azt tudjuk, hogy, az elmélet szerint az elektrolitos disszociáció, a vizes oldatban az oldott anyag-részecskék kölcsönhatásba lépnek a vízzel molekulákkal. Az ilyen kölcsönhatás lehet eredményezheti hidrolízisét a reakció (a görög Hydro - víz, lízis - bomlás rasiad).
Hidrolízis - a reakció, hogy a bővítés a cseréjét anyagok vízzel.
Hidrolízis alávetni különböző anyagok: szervetlen - só, karbidok, és a fém-hidridek, halogenidek nem-fémek; szerves - halogén-alkánok. zfiry komplex és zsírok, szénhidrátok, fehérjék, polinukleotidokat.
hidrolízis reakciók előfordulhatnak reverzibilisen és visszafordíthatatlanul. Tekintsük a különböző esetekben ezt a folyamatot és annak jelentőségét.
Hidrolízise szerves anyagok
1. hidrolízise halogénalkánok használt hosszúságú alkoholok előállításának.
Alkália jelenlétében (OH) lehetővé teszi, hogy „kapcsolat”, és az így kapott savat, hogy kiszorítsa az egyensúlyi keletkezése irányába az alkohol.
2. A hidrolízis reverzibilisen zfirov komplex savas közegben (jelenlétében egy ásványi sav), így a megfelelő alkohol és karbonsav.
Hogy ellensúlyozzák a kémiai egyensúly felé hidrolízise a reakciótermékek végezzük jelenlétében alkálifém.
Történetileg, az első példa erre reakció lúgos hasításával észterek magasabb zsírsavak, így a szappan. Ez történt 1811-ben, amikor egy francia tudós E. Chevreul. fűtés a zsír és a víz bázikus közegben, a glicerin és a szappanok kapott - sói magasabb karbonsavak. A kísérlet alapján állítottuk készítmény zsírok voltak komplex PFI-set, de csak a „három nehéz. háromértékű alkohol, glicerin-származékok - triglitseridamn. Eljárás észter-hidrolízis lúgos közegben még mindig nevezik „elszappanosítási” .Naprimer, elszappanosításával észter, amelyet a glicerin, palmitinsav és sztearinsav:
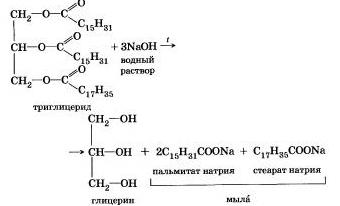
Nátrium-sói magasabb karbonsavak - a fő összetevői a szilárd szappan a kálium-só - folyékony szappan.
Francia kémikus M. Berthelot 1854 végzett észterezési reakcióval és az első szintetizálni zsír. Ezért a hidrolízis a zsír (és egyéb észterek) végbemegy reverzibilisen. reakcióegyenlet lehet egyszerűsíteni írható:
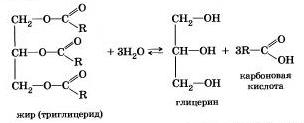
Az élő szervezetekben, van egy enzimatikus hidrolízise zsírok. A belekben hatása alatt egy lipáz enzim gidratizuyutsya élelmiszer zsírok glicerin és szerves savak, amelyek felszívódnak a bélfalon, és a szervezetben szintetizálni új zsírok rejlő az adott szervezetben. Ezek nyirokrendszer, bekerül a véráramba, majd a zsírszövet. Ezért zsírok lépnek más szervek és szövetek, a test, ahol a folyamat az anyagcsere a sejtekben, majd ismét hidrolizáljuk fokozatosan oxidáljuk, szén-dioxid és víz felszabadulása energia szükséges az élethez.
Zsírok hidrolízisét a szakterületen előállítására alkalmazott glicerin, nagyobb karbonsavak szappanok.
3. Mint tudod, szénhidrátok lényeges elemei ételeinket. Továbbá di- (szacharóz, laktóz, maltóz), és poliszacharidokat laboratóriumi és ipari körülmények között használva ezeket a folyamatokat, mint savas katalizátor jelenlétében. A reakciókat melegítés közben végezzük.
A hidrolízises reakciót keményítő glükózzá katalitikus hatása alatt kénsav szállított 1811-ben, az orosz tudós K. S. Kirchhoff.
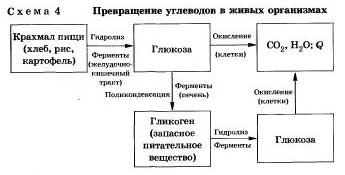
Emberekben és állatokban szénhidrát hidrolízis hatására az enzimek (4. reakcióvázlat).
Ipari hidrolízisével nyert keményítő glükóz és melasz (keveréke dextrinek, maltóz és glükóz). Melasz használják az édesipari vállalkozás.
Dextrin, mint a termék részleges keményítő hidrolízise mutatnak tapasztó hatása: azok kapcsolódó megjelenése barna kenyér és sült burgonya, valamint kialakulását a sűrű film nakralmalennom mosodai hatása alatt a forró vas.
Egy másik jól ismert, hogy úgy poliszacharid - cellulóz - is hidrolizálhatók glükózzá hosszan tartó melegítés ásványi savakkal. A folyamat megy lépésről lépésre, de röviden. Ez a folyamat az alapja számos hidrolitikus termelés. Ezek szolgálnak az élelmiszer, takarmány és nem élelmiszer termékek műszaki nyers vegetáció - apadék, fa (fűrészpor, forgács, háncs), feldolgozási növények (szalma, maghéjra, kukorica szára, stb ...).
Műszaki termékek az ilyen iparágak glicerin, etilén-glikol. szerves savak, takarmány élesztő, etil-alkohol, szorbit (hexahydroxyalcohols).
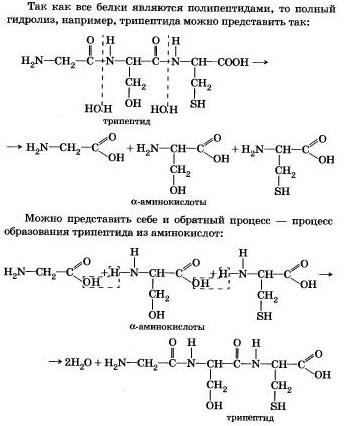
4. Tudtad, hogy a fehérjék biopolimerék - az élet alapja az élő organizmusok (a vírus emberre) - alkotják főként aminosavak (A 20 leggyakoribb). Szekvenálása elrendezése aminosavak alkotó egy fehérje-molekula, amely a kezdeti célja a vizsgálat annak szerkezetét. És ez segít beállítani lépésenkénti hidrolízises folyamatot a fehérje, amely hevítésével végezzük savakkal vagy lúgok, valamint a az enzimek működését.
5. mérhetetlenül fontos szerepet a szervezetben játszik a hidrolízis az adenozin-trifoszfát (LTP). Ez az anyag szolgál energiaforrásként mindenféle biokémiai reakciók (fehérje épület, izom-összehúzódás, stb.) A hidrolízist az ATP adenozin difoszfát (ADP), az energia felszabadul.
A fordított folyamat kialakulását ATP ADP történik energia elnyelését. Ezért. ATP az univerzális energia cella anyag.
Sók vizes oldatai pH különböző értékeket és a különböző típusú média - savas (pH = <7), щелочную (рН> 7), semleges (pH = 7). Ez annak a ténynek köszönhető. hogy a sók vizes oldatban lehet hidrolizáljuk.
ÖSSZEFOGLALÁS hidrolízis csökkenti kémiai kölcsönhatás a csere kationok vagy anionok sók a vízmolekulákat. Ennek eredményeként ez a kölcsönhatás alakul malodisso-ségben vegyületet (gyenge elektrolit). És egy vizes sóoldatban van egy felesleges szabad ionok H + vagy OH és sók tolóerő válik savas vagy lúgos, ill.
Bármely só lehet jelen, mint a reakció terméke egy bázis kislotoy.V függően a bázis és a sav erőssége lehet megkülönböztetni négyféle sók (lásd a 6. reakcióvázlatot).
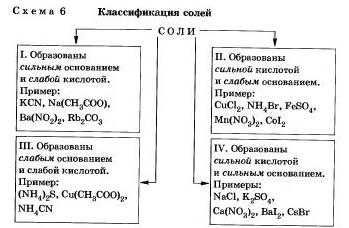
Nézzük meg a viselkedését különböző sók oldatban
I. képzett sók erős bázissal és egy gyenge sav
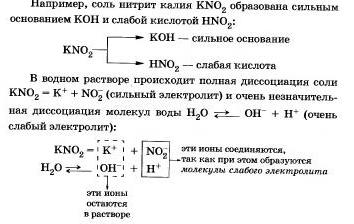
A folyamat reverzibilis, kémiai egyensúly balra tolódik (képződése irányába kiindulási anyagok), például a víz - lényegesen gyengébbek elektrolit, mint a salétromossav.
Rövidített ion hidrolízis szúró egyenlet:
a) az oldatban szabad gidroksoiony OH és azok koncentrációja magasabb lesz, mint a tiszta víz, így KN02 sóoldat lúgos környezetben (pH> 7);
b) reakciót vízzel részt anionok N02-; Ebben az esetben azt mondjuk, hogy a hidrolízis anion.
További példák az anionok, amelyek részt vesznek a reakcióelegyet vízzel:
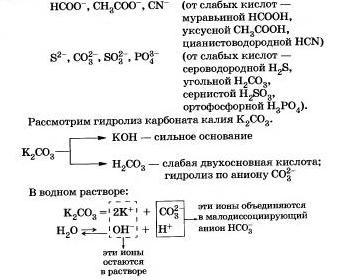
Összefoglalva, mit tanultunk a hidrolízis anion:
a) egy sóját egy anion, általában reverzibilisen hidrolizál;
b) a kémiai egyensúly az ilyen reakciók erősen balra mozdult;
c) a reakcióközeget oly solm lúgos oldatok (pH> 7);
g) hidrolízisével képződött sók gyenge bázisú savak, a savas sókat kapunk.
Alkotott sók egy erős sav és egy gyenge bázis.
Például, úgy a hidrolízis NN4I ammónium-jodid.
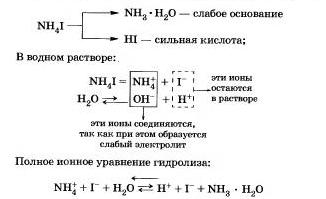
A folyamat reverzibilis, a kémiai egyensúly felé tolódik el a kialakulását a kiindulási anyagok, mivel a víz H20 elektrolit jelentősen gyengébb, mint az ammónia-hidrát.
Az egyenlet azt mutatja, hogy:
a) az oldatban szabad hidrogén ionok H és azok koncentrációja magasabb lesz, mint a tiszta vizet, így a sót oldat savas közegben (pH = <7);
b) reakciót vízzel részt ammónium kationok; Ebben az esetben azt mondjuk, hogy a hidrolízis a kation.
A reakciót víz is részt vehetnek, és többszörösen töltött kationok: kétszeres töltésű M2 +. kivéve kationok alkáliföldfémek, háromszorosan + Me3.
Tekintsük hidrolízis NiSl2 nikkel-kloridot.
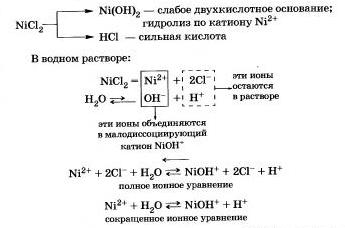
A hidrolízis termékek - Ni0NSl bázisos sót és sósav HCI.
vizes nikkel-klorid-oldattal savassága a közeg (pH = <7), потому что в растворе увеличивается концентрация ионов
A hidrolízis Ni0NSl só keletkezik, hogy sokkal kisebb mértékben, és el lehet hanyagolni.
Összefoglalva, mit tanultunk a hidrolízis a kation:
a) kation-sók általában hidrolizáljuk reverzibilisen
b) a kémiai egyensúly a reakció balra tolódik
III. Alkotott sók egy gyenge bázissal és egy gyenge sav.
Te nyilván egyértelmű, hogy az ilyen sók hidrolizál kation és anion.
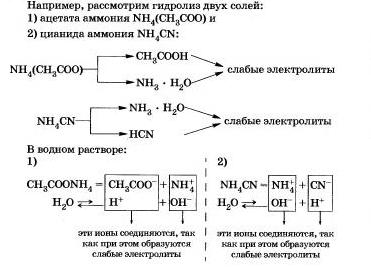
Ahogy talán már észre, a legtöbb só hidrolízise megfordítható folyamat. Azonban néhány só teljesen bomlik vízben, m. E. A hidrolízis egy visszafordíthatatlan folyamat.
következtetéseket:
a) Amennyiben a só és a hidrolizált kation és anion, de reverzibilis, a kémiai egyensúly a hidrolízis reakciók jobbra tolódik;
b) a reakcióközeget vagy semleges, vagy gyengén savas vagy gyengén lúgos, attól függően, hogy az arány a disszociációs állandók a bázisok és savak képződik;
c) a só lehet hidrolizálni, és kation és anion irreverzíbilisen, ha legalább az egyik a hidrolízis termékek ki a reakció szférában.
IV. Képzett sók erős bázissal és erős sav nem hidroiizái. Ez a következtetés akkor jön, nyilván magukat.
Tekintsük a „viselkedés” oldatot kálium-klorid KCl.
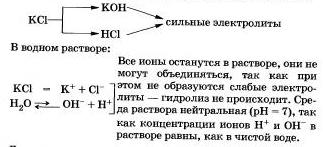
További példák az ilyen sók lehetnek nitrátok, perklorátok, szulfátok, kromit és dikromátok alkálifémek, halogenidek (kivéve fluorid), nitrátok, perklorátok és alkáli földfémek.
Ahhoz, hogy információt gyűjtsenek a hidrolízis sók a 14. táblázatban Azt is meg kell jegyezni, hogy a hidrolízis reakció teljesen visszafordítható az elvnek a Le Chatelier. Ezért tudjuk fokozza a hidrolízis sók (sőt, hogy irreverzibilis) az alábbi módokon:
a) víz hozzáadásával (koncentrációjának csökkentésére);
b) az oldat melegítése, és így erősítik azt a endoterm disszociációs víz, és ezáltal növeli a száma H és OH. amelyek szükségesek a sót hidrolizálják;

c) társítani egyik hidrolízis termékek oldható vegyületek vagy távolítsa el az egyik termék a gázfázisban; például hidrolízissel ammónium-cianid jelentősen javul majd lebontásával ammónium-hidroxiddal reagáltatjuk ammónia és a víz.
A hidrolízis lehet elnyomni (jelentősen csökkenti a só mennyisége áteső hidrolízis:
a) növeli a koncentrációt az oldott anyag
b) az oldatot lehűtöttük;
a) bevezet egy megoldás szerint egy a hidrolízis termékek; így például, savasítsuk az oldatot, ha a reakciót hidrolízissel a sav vagy lúgosítják, ha - lúgos.
Hidrolízise só gyakorlati és biológiai jelentősége
Már az ókorban, mint a használt mosószer hamu. A hamu kálium-karbonátot tartalmaz, amelyet hidrolizálunk víz a anion, a vizes oldat színe habzásnál miatt hidrolízisével állítjuk elő; OH-ionok.
Jelenleg a mindennapi életben, az általunk használt szappanok, mosószerek és egyéb tisztítószereket. Basic szappan komponens - a nátrium- vagy kálium-sók a nagyobb szénatomszámú zsírsav karbonsavak: sztearátok, palmitátok, hidrolizálunk.
A kompozíció a detergensek és egyéb tisztítószerek speciálisan beadni szervetlen savakkal képzett sókat (foszfátok, karbonátok), amelyek mosóhatás fokozása a pH emelésével a közeg.
Só, hogy megteremtse a szükséges lúgos oldat a fotográfiai fejlesztő. Ez a nátrium-karbonát, kálium-karbonát, a bórax és egyéb sók, hidrolizálható de anion.
Ha a talaj savassága nem elegendő, a növények az új betegségek - klorózis. Tünetei - sárguló vagy fehérítő a levelek, satnya növekedés és fejlődés. Ha a pH> 7,5, akkor készült ammónium-szulfát műtrágya, amely hozzájárul a savasságot hidrolízise miatt a kation elhaladó pochve.Neotsenima biológiai szerepe a hidrolízisét néhány só, egy része a test.
Megjegyezzük, hogy nem változik a reakciók a hidrolízis oxidációs foka a kémiai elemek. Redox reakciók hidrolízis reakciók tipikusan nem hordozzák, bár a reakció történik és az anyag vízzel.
1. Select példák az olyan szerves anyagok, áteső hidrolízis:
glükóz, etanol, bróm-metán, metanal, szacharóz, metil-észter-hangyasav, sztearinsav, 2-metil-bután.
Tedd az egyenlet hidrolízis reakciók; abban az esetben, reverzibilis hidrolízis határozza meg a feltételeket, amely lehetővé teszi, hogy eltolja a kémiai egyensúlyi keletkezése irányába a reakciótermék.
2. Melyek a sók hidrolizál? Bármilyen közeg lehet vizes sóoldatot? Adjon példát.
3. Milyen sók hidrolizál kation? Tedd az egyenlet hidrolízis válassza szerdán.
4. Milyen sókat hidrolizált az anion?
5 *. Bármelyikének hozzáadásával a következő anyagok a vas-klorid (III) növelni fogja a hidrolízis sók: sósav, nátrium-hidroxid, ZnCl2? Adjon magyarázatot.
6. Javasolj módszerek visszaszorítására hidrolízise vizes kálium-szulfid.