Ami az utóbbi kapcsolatban, hogy egy moláris tömege keverék
Miután megoldotta az egyenletrendszer találunk ismeretlen N1 és N2:
Kifejezése a képletekben megjelenő értékeket SI egységek helyett az értékek, számítások elvégzése, megkapjuk
1.2. A belső energia és hőkapacitása ideális gáz
Vnutrennyayaenergiyagaza összege az energia az egyes molekulák. Az egyik kmol bármely gáz molekulák tartalmazott NA (NA Avogadro --chislo). Következésképpen az egyik kilomole ideális gáz van egy belső energia egyenlő
A belső energia tetszőleges gázzal m tömegű:
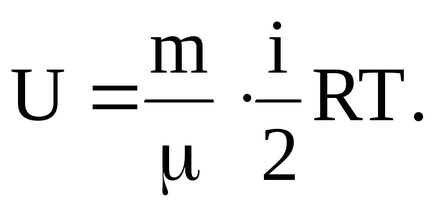
ahol - moláris tömege a gáz.
Fajlagos hő kapacitás „c” a gáz nevezzük fizikai mennyiség, amely numerikusan ravnayakolichestvu hőt, ami kell jelenteni, hogy az egyik a gáztömeg, hogy melegítse azt egy fokkal.
Moláris hőkapacitás „C” nevezzük a fizikai mennyiség, amely számszerűen egyenlő a hő mennyiségét kell jelenteni, hogy egy mól gáz, hogy növelje a hőmérsékletet egy fokkal.
Közötti kommunikáció specifikus és moláris hőkapacitás:
A moláris fajhő állandó térfogaton „Cv” - fizikai mennyiség számszerűen egyenlő a hőmennyiség korlátozza, amelyet be kell jelenteni, hogy egy mól gáz, hogy növelje a hőmérsékletet egy fokkal egy állandó térfogatú.
A moláris fajhő állandó nyomáson „Cp” - fizikai mennyiség számszerűen egyenlő a hőmennyiség korlátozza, amelyet be kell jelenteni, hogy egy mól gáz, hogy növelje a hőmérsékletet egy fokkal körülmények között állandó nyomás.
Ha a gáz melegítjük állandó térfogaton, a szállított gáz a hőt idotna növelje belső energia. Következésképpen ebben az esetben a változás a belső energiája a gáz prinagrevanii ez egy fokkal egyenlő molyarnoyteploomkosti
Amikor melegítjük molyagaza usloviyahpostoyannogo kifejtett nyomás, hogy kívülről hő nem csak növeli a belső energia, hanem a munkavégzéshez külső erőkkel szemben.
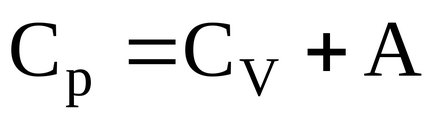
Által végzett munka bővítése egy mól gáz állandó nyomáson
ahol R - egyetemes gázállandó.
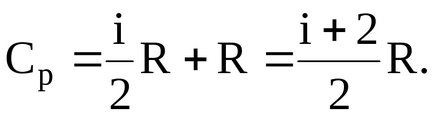
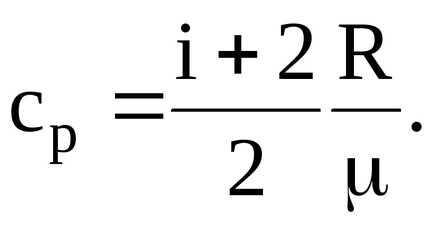
1.2. Példák problémák megoldása
1.2.1. Számítsuk ki a konkrét futamok állandó nyomáson és állandó térfogaton neon és hidrogén csapágy gázok az ideális.
Határozat. Közötti moláris és fajlagos hő ideális gáz állandó nyomáson és állandó térfogaton van egy link:
Így udelnyhteploemkostey van:
Annak ismeretében, hogy neon odnoatomnyygaz dlyanego szabadsági fok i = 3, = 2010 -3 kg / mol, és a hidrogén-gáz számára, hogy a dihidroxi-szabadsági fok i = 5, = 2710 -3 kg / mol. Behelyettesítve mindegyik fenti képletekben rögzített érték és az értéke az egyetemes gázállandó R = 8,31 J / (molK) kiszámításához fajhő:
.
1.2.2. Hányszorosa konkrét futamok állandó nyomáson és állandó térfogatú oxigént.
Határozat. Az arány a konkrét futamok állandó nyomáson és állandó térfogatú egy ideális gáz megegyezik annak mólaránya specifikus futamok állandó nyomáson és állandó térfogatú:
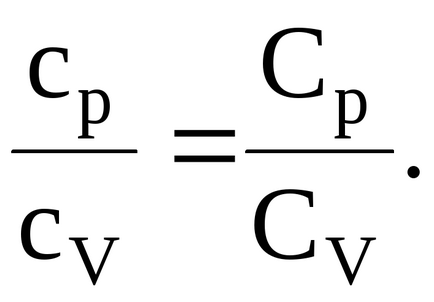
Ismerve, hogy a moláris fajhő állandó nyomáson és állandó térfogaton, kapcsolódó száma szabadsági fok és
Az arány adott futamok lesz
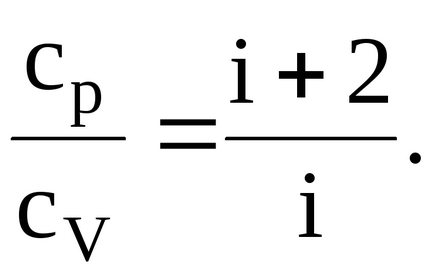
Oxigén, kétatomos gáz, következésképpen, a száma a szabadsági fokok i = 5. Behelyettesítve érték azt vyshezapisannuyu formula, van:
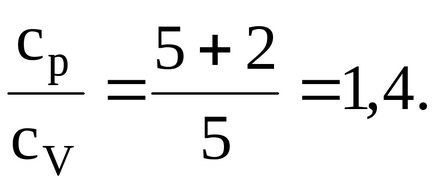
1.2.3. Fajhője kétatomos gáz 14,7 kJ / (kgK). Keresse moltömegére a gázt.
Határozat. Ismeretes, hogy a fajhő állandó nyomáson moláris fajlagos hő társított gáz:
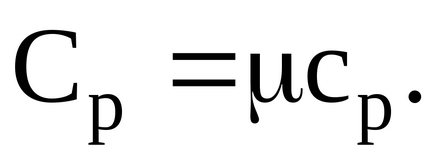
A moláris fajhő állandó nyomáson
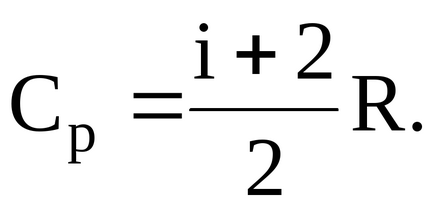
ahol - a szám a szabadsági fok a gáz.
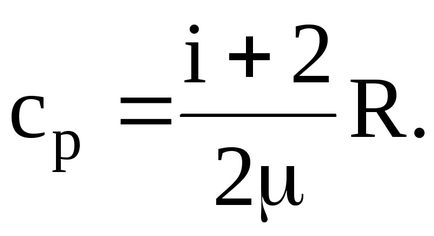
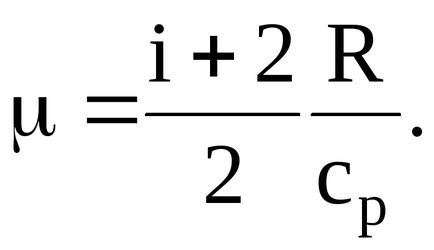
Podstavlyayav képlet kapott adatokat értékeket a probléma mennyiségben, juttatás az a tény, hogy a kétatomos gáz i = 5, van:
1.2.4. Számítsuk ki a fajhő állandó térfogaton és állandó nyomáson, keveréke neon és hidrogénatom, ha a tömeghányad a neon és hidrogén képeznek 1 = 80% és 2 = 20%, ill. A fajlagos hőkapacitás egy neon CV = 6,2410 2 J / (kgK) CP == 1,0410 3 J / (kgK); hidrogén-CV = 1,0410 4 J / (kgK) cp = = 1,4610 4 J / (kgK).
Határozat. Általában a szükséges hőmennyiséget a fűtés a gázok keveréke, például melegítéssel egy állandó térfogatú a hőmérséklet T1 hőmérsékletre T2 egyenlő:
ahol CV (cm) - fajhője a keverék;
(T2 -T1) - hőmérséklet-változás.
Másrészt, ez a hőmennyiség lehet vychislenopo képletű:
ahol Q1 és Q1 - ennek megfelelően a hőmennyiség korlátozza, amelyet meg kell
jelenteni, hogy a hőmérsékletet a neon és hidrogén egyenként;
CV1 és SV2 - fajhője neont vagy hidrogént állandó térfogat;
m1 és m2 - tömege neon és hidrogén.
Így van:
ahol
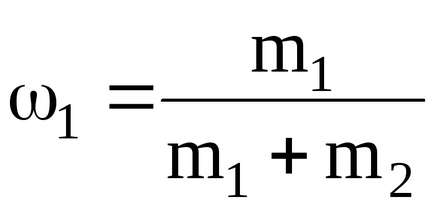
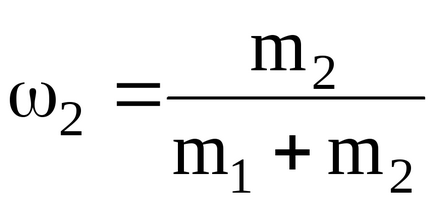
Podstavlyayachislennye értékeket udelnoyteploemkosti elegyet ivodoroda neon postoyannomdavlenii, budemimet:
Hasonlóképpen állíthatjuk elő a képlet meghatározására fajhője a keverék a neon és hidrogén állandó nyomáson:
Behelyettesítve a numerikus értékek a fajhő állandó nyomáson a keverék, van:
1.2.5. Oxigén 2 kg foglal térfogatban V1 = 1 m3, és a p1 nyomás = 0,2 MPa. Gáz-ra melegítjük, az első állandó nyomáson térfogatra V2 = 3. 3 m, majd állandó térfogaton egy p3 nyomás = 0,5 MPa. Keresse meg a változás belső energiája a gáz.
Határozat. Változás a belső energia a gáz
ahol CV = iR / 2 - fajhő állandó térfogaton;
- moláris tömege a gáz;
T = (T2 - T1) - változik a gáz hőmérséklete a végső és kezdeti állapotok;
i = 5 - száma szabadsági fokok (kétatomos oxigén gáz).
A gáz hőmérséklete a kezdeti és a végső állapotokat lehet meghatározni egyenletből Mengyelejev-Clapeyron
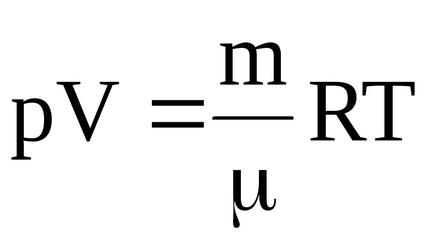
A kezdeti hőmérséklet
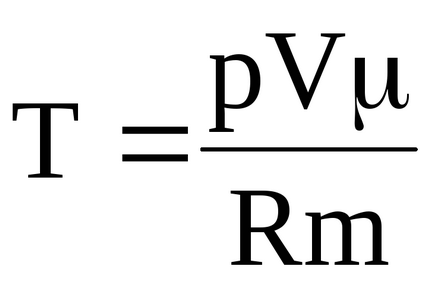
Egy véges hőmérsékletű
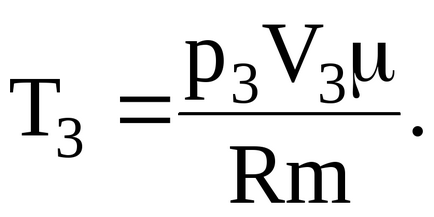
Akkor változik vnutrenneyenergiigaza
Podstavlyayachislennye értékek, van
1.2.6. Tömegspektrum, m = 10 g oxigén nyomása p = 0,3 MPa nyomáson és 10 ° C-on történő melegítés után állandó nyomáson gáz került V2 = térfogata 10 liter. Find a hőmennyiség Q, a kapott gáz, és termikus mozgás energiája gázmolekulák W hevítés előtt és után.
Határozat. A Q hőmennyiség, a kapott gáz fűtés közben
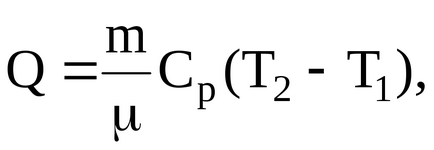
ahol
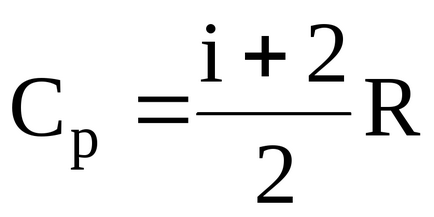
i = 5 - száma szabadsági fokok (kétatomos oxigén gáz);
R = 8,31 J / (mol7K) - egyetemes gázállandó;
= 0,032 kg / mol, - a molekulatömeg oxigén;
T1 és T2 - a gáz hőmérséklete a kezdeti és a végső állapotok. Annak megállapításához, a gáz hőmérséklete a végső használatra kész állapotban, a kapcsolat a hőmérséklet és a gáz mennyisége, melegítjük állandó nyomás alatt:
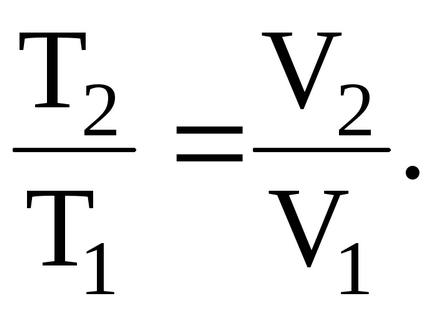
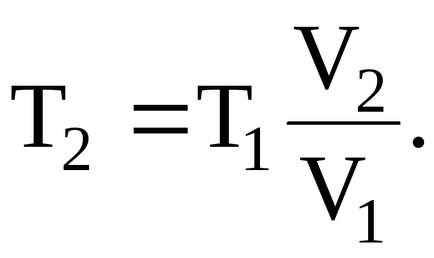
Az egyenlet a Mengyelejev-Clapeyron egyenlet:
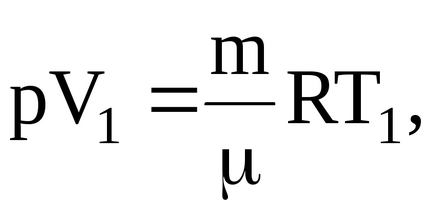
nahodimobem gáz a kezdeti állapot:
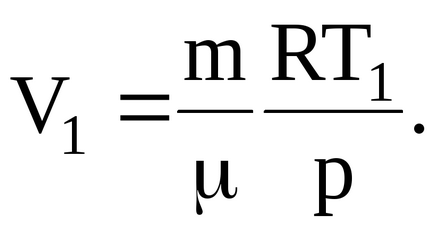
Mi lesz az arány a végső hőmérséklet:
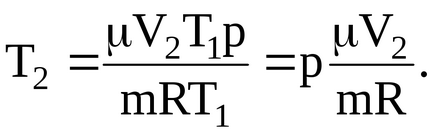
Behelyettesítve a numerikus értékek határozzák meg a végső gáz hőmérséklete:
Podstavlyayachislennye érték az az összeg a termelt hő a fűtési folyamat gáz:
Hőmozgás energiája a gáz molekulák opredelitpo képletű
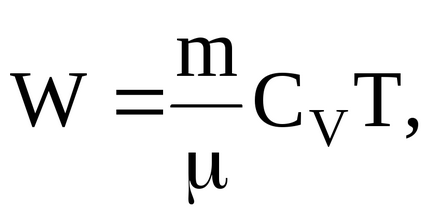
ahol CV = iR / 2 - moláris hőkapacitása gáz állandó térfogaton.
Így a hőmozgás energiája gázmolekulák a kezdeti állapotban, van:
A végső állapot:
.
1.2.7. Oxigén 2 kg foglal térfogatban V1 = 1 m 3, és a p1 nyomás = 0,2 MPa. Gáz-ra melegítjük, az első állandó nyomáson térfogatra V2 = 3. 3 m, majd állandó térfogaton egy p3 nyomás = 0,5 MPa. Keresse meg a változás belső energiája a gáz, hogy a munka tökéletes, és melegség továbbított gáz.
Határozat. Köztudott, hogy a változás a belső energia a gáz arányban a hőmérséklet-változás, a
Egyenletből Mengyelejev-Clapeyron
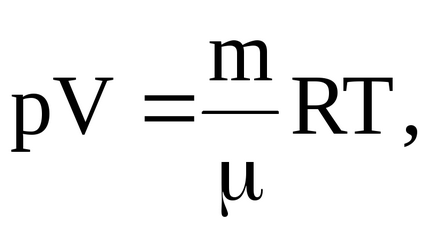
Meg tudja határozni a hőmérséklet jellemző a megfelelő kimondja:
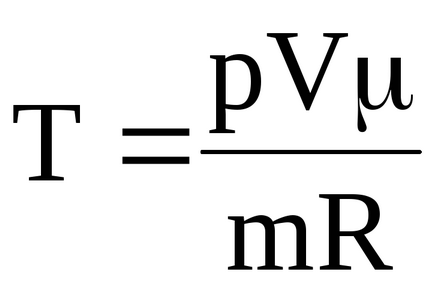
Így, a gáz hőmérséklete a kiindulási állapotban
Ezért változtatni a belső energia a gáz való áttérés a kezdeti állapotból a végső állapot, van:
A mozgó gáz végzett munka
ahol A1 - gáz munka, kelt az átmenet a nyomás állandó körülmények között;
A2 - gáz munka kelt, az átmeneti körülmények között az állandó térfogatú.
Gáz elvégzett munka után átmenetet egy állandó nyomást feltételeket viszonya határozza meg:
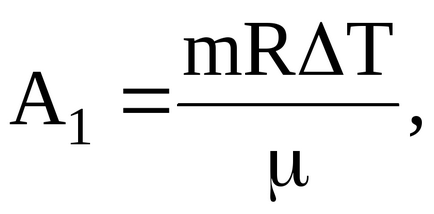
gáz- és munka átmenet alatt az állandó térfogat:
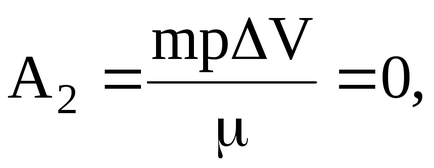
Így, ebben az esetben
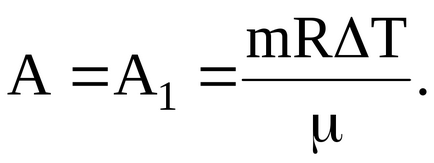
Az átadott hőmennyiség, hogy a gáz egyenlő a változás mértéke a belső energia és a munkát az általuk,
Miután ellenőrizte a dimenzió helyett pedig számértékek, van
T1 = 0,210 6 13210 -3 / 8,3110 3 2 = 385 K;
T2 = 0,210 6 33210 -3 / 8,3110 3 2 = 1155 K;
T3 = 0,510 6 33210 -3 / 8,3110 3 2 = 2888 K;
U = 528,31 (2888-385) / 23210 -3 = 3,2510 3 J;
A = 28,31 (1155-385) / 3210 -3 = 0,410 3 J;
Q = 3,2510 + 0,410 3 3 3 J = 3,6510.
1.2.8. Súly 12 g nitrogén van a zárt edényben a mennyiség
V = L 2 a t = 10 o S.Posle fűtés a nyomás az edényben volt egyenlő p = 1,33 MPa. Mi hőmennyiség Q jelentett hevítéskor gázt?
Határozat. Mivel a gáz mennyisége nem változott, az üzenet a hőmennyiség ment, hogy módosítsa a belső energia
amely viszont lehet meghatározni:
ahol Cv = iR / 2 - moláris fajhő állandó térfogaton nitrogén.
Annak meghatározására, a végső hőmérséklet a T használni azt a tényt, hogy a prinagrevanii a gáz állandó nyomás alatt térfogatarány arányos viszonyítva az hőmérséklete a kezdeti és a végső állapotok p1 / p2 = T1 / T2.
Nachalnoe nyomást a következő egyenletből meghatározzuk Mengyelejev-Clapeyron rögzített az eredeti állapot:
Mivel a hipotézis problémát V1 = V1 = V, akkor van a végső hőmérséklet:
Behelyettesítve a értéke T2 a képletben változása a belső energia, amely egyenlő a hőmennyiség-jelentett gáz végül kapjuk:
Dimenzionalitásának az eredmény nyilvánvaló. A számértéke Q egyenlő
Q = 4,1310 3 J = 4,13 kJ.
1.2.9. A henger kapacitása V = 20 l oxigén nyomáson p = 100 ATM és a hőmérséklet 7 t = o C-ra melegítjük fel t = 27 ° C hőmérsékleten Milyen mennyiségű hőt így elnyeli a gáz?
Határozat. Mivel a hőtágulási együtthatók a szilárd anyag szignifikánsan kisebb (körülbelül százszor), mint a gázok, a körülmények ennek a problémának figyelmen kívül lehet hagyni, és tekinthető kiterjesztése a palackos gáz izochor fűtési folyamat.
Amikor izochor folyamat, eljutnak a rendszer, az a hőmennyiség, hogy megváltoztatjuk a belső energia.
A meghatározása moláris hőkapacitás, ebből következik, hogy egy elemi hőmennyiség átadódik a szervezetbe növekvő hőmérséklete dT, egyenlő: dQ = CV dT.
Móljainak a száma található a állapotegyenlet gáz (Mengyelejev-Clapeyron) = m / = p1 V / RT1.
Mivel a gáz melegítjük állandó térfogaton, akkor C = CV. ahol CV = iR / 2.
Behelyettesítve értékek CV és a képlet az elemi mennyiségű hőt, kapjuk:
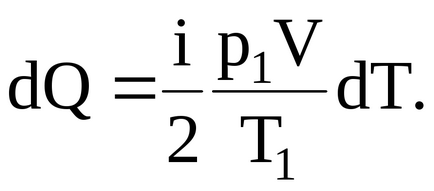
Ezért, integrálása, valamint figyelembe véve, hogy az értékek i, p1. T1. V - állandó, azt találjuk, a teljes összeg által elnyelt hő a gáz hevítve a T1-T2. ami számszerűen egyenlő és izmeneniyuego belső energia:
Miután ellenőrizte a dimenzió helyett ez a képlet a mennyiségek értékeit tartalmazza az SI rendszerben végzünk számításokat:
U = 59,810 5 210 -3 (300-280) / 2280 = 3510 3 J = 35 kJ.