Atomic kristályszerkezetét fémek, anyagok
Under atomi-kristályos szerkezet megérteni a kölcsönös elrendezése az atomok (ionok) létező valódi kristály.
A szilárd állapotban fém egy építési amely egy pozitív töltésű ionok, mosott „gáz” beszerezhető a vándorló elektronok. Kommunikáció a fém végzi elektrosztatikus erők. Között ionok és elektronok előforduló vándor ingerületvezetési elektrosztatikus vonzóerők amely húzza ionokat. Az ilyen kötés az úgynevezett fém.
Kötőerők fémekben határozza meg az erők a taszító és vonzó erők közötti ionok és elektronok. Atomok (ionok) vannak elhelyezve, olyan távolságra egymástól, ahol a kölcsönhatási energia minimális.
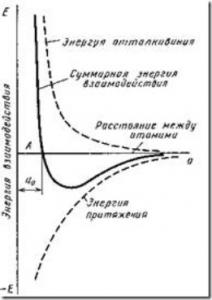
Ábra. 4. sematikus a kölcsönhatási energia két atom között függvényében az atomközi távolsági
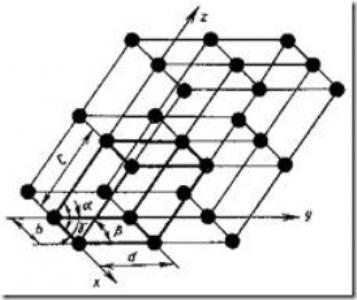
Ábra. 5. ábra a kristályrács
Amint az ábrából látható. 4, ez a helyzet megfelel az egyensúlyi távolság a0. Közelítése atomok (ionok) a parttól kevesebb, mint a0, vagy eltávolítja őket a nagyobb távolságra a0, lehetséges csak ha így bizonyos munka erői ellen a taszítás és a vonzás.
Ezért, a fém atomok vannak elrendezve rendszeresen egy szabályos kristályrácsban, amely megfelel a minimális kölcsönhatási energia atomok.
kristályrács
A kristályrács (ábra. 5) áll, képzeletbeli vonalak és síkok áthaladó ion elrendezése pontok a térben. Vastag vonalak származó legkisebb parallelepipedon szekvenciális mozgása, amely mentén a három tengely a teljes kristály építhető.
A legkisebb térfogata a kristály, amelyek képet adnak a atomi szerkezetének a fém bármilyen mennyiségben, mivel a neve az elemi cella a kristály.
Az egyedülálló jellemzői a következő értékeket kell ismert: három éle (a, b és c), valamint a három szög a tengelyek között.
A legtöbb fém egyikét képezik az alábbi nagy szimmetria rácsok a sűrű atomok: tércentrált köbös, lapcentrált köbös és hexagonális (6. ábra).
Amint az ábrából látható. 6, és, egy test-középpontos köbös rács (BCC) a atomok csúcsainál helyezkednek el egy kocka és egy másik atom közepén a kocka térfogata. Body-középpontos köbös rács van fémek: Pb, K, Na, Li, Ti, Zr, Ta, W, V, Fe, Cr, Nb, Ba, és mások.
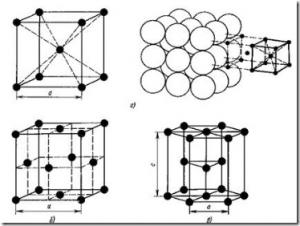
Ábra. 6. fémrács: és - egy tércentrált köbös (BCC); b - a lapcentrált köbös (FCC); in - hexagonális szoros illeszkedésű (hcp)
lapcentrált rács
Az arc-központú köbös rács (FCC) atomok vannak elrendezve a sarkokban egy kocka és a központ minden arc (6B.).
A hexagonális rács (. Ábra 6, c) az atomok csúcsainál helyezkednek el, és központ a hatszög hasáb bázisok, és három atom - a középső síkjában a prizma.
A távolságok a, b, c középpontjai között szomszédos atomokban az elemi cellában nevezzük rács időszakokban. A rács időszak nanométerben kifejezve (1 nm = 10-9 cm).
osztásperiódus legtöbb fémre belül 0,1-0,7 nm.
Az egyik elemi cella tércentrált rács esnek két atom, egy a központban a kocka, és a többi atom kerülnek bevezetésre, amelyek található a csúcsai a kocka (tetején minden atom a kocka egyidejűleg tartozik nyolc párosított egység sejtek és ez a sejt tömege 1/8 az atom, és a teljes sejt 8 1/8 X = 1-atom).
A felületen középpontos köbös elemi cellájának a rács alá négy atom; egyikük (szerint ugyanazt a számítást, mint a test-központú köbös rács) atomok be a csúcsai a kocka, és összesen három ((1/2) X 6 = 3) atomokat közepén helyezkedik el az él, mint minden ilyen atomok tartozó két rácsok.
Ábra. 7. ábra bemutatja az atomok számát egyenlő, és a legközelebb az atom jelen különböző kristályrétegeiben (SS Steinberg): és - K8; b - K12; in - G12
Az elemi cella a hexagonális, szoros csomagolt rács atomok tartoznak hat (3 + (1/6) X 12 + (1/2) x 2 = 6).
rács sűrűség - által elfoglalt térfogat az atomok, amelyeket durván tekinthető merev golyó, azzal jellemezve, koordinációs száma ami azt jelenti, az atomok száma egyenlő és legkisebb távolság egy adott atom. Minél magasabb koordinációs szám, annál nagyobb a tömörítési sűrűsége az atomokat.
Az elemi cella a test-központú köbös rács, a legrövidebb az atomok közötti távolság megfelelő d = 0,5 A \ / 3. Ezen távolság 8 szomszédok ettől a atom (ábra. 7a). Következésképpen a koordinációs száma BCC megfelel a 8. és a kijelölt K8. Együttható tömörség sejt, arányaként definiáljuk a által elfoglalt térfogat az atomokkal sejttérfogat összege 68% BCC.
A lapcentrált köbös rács koordinációs száma 12 (K12); minden egyes atom 12 legközelebbi szomszédai a parttól d = 0,5 A \ / 2 (ábra. 7b), amely megfelel a maximális sűrűség csomagolás vagy csomagolás formájában golyókat. A hexagonális, szoros csomagolt rács, melyek a / a = 1,633, koordinációs száma 12 (G12), ami szintén megfelel a maximális sűrűségű csomagolására gömbök (atomok) (ábra. 7c). Sok fémek kristályosodik a hexagonális rendszerben az arány c / a tartományban van, 1,57 - 1,64 .., tehát eltérhet a legközelebb csomagolás, ahol a c / a = 1.633. Ha az arány a C / A értéke 1.633 jelentősen eltérő (például, cink és kadmium), a koordinációs száma 6 megfelel a hexagonális rács.
A lapcentrált köbös és hexagonális szoros illeszkedésű (c / a = 1.633) a rács - legkompaktabb; ott tömörség tényező 74%.
Amikor csökkenti a koordinációs számának a hexagonális rácsban 12-6 tömörség koefficiens körülbelül 50%, és a koordinációs szám 4 - körülbelül 25%.
Fele közötti legrövidebb távolságot atomot tartalmaznak a kristályrács nevezett atomrádiusz. Az atomi sugara növekszik a csökkent a koordinációs számát, mivel ez megnöveli a teret az atomok közötti. Ezért a atomrádiuszok a különböző fémek általában adott K12.