Móltömeg a hidrogén-klorid (HCI), és példák a általános képletű
A moláris tömege hidrogén-klorid
Hidrogén-klorid (sósav, hidrogén-klorid) - egy komplex anyag szervetlen természetű, amely létezik mind folyékony és gáz halmazállapotú.
A második esetben ez egy színtelen gáz, oldódik vízben, és az első - az erős savas oldat (35-36%). A szerkezet egy molekula hidrogén-klorid, és annak szerkezeti képlet ábrán látható. 1. sűrűség - 1,6391 g / l (STP). Az olvadáspont - (-114,0 ° C) forráspontú - (-85,05 o C).
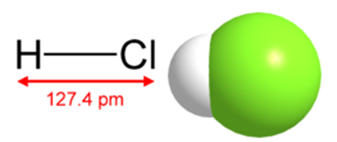
Ábra. 1. A szerkezeti képlet és a térszerkezet egy molekula a hidrogén-klorid.
Molekuláris képlet hidrogén-klorid - HCl. Mint ismeretes, a molekulatömege a molekula az összege a relatív atomi tömegek a atom alkotja a molekula (relatív atomtömeg értékeket vett Mendeleev Periódusos Táblázat egész számra kerekítve).
Mr (HCl) = Ar (H) + Ar (Cl);
Mr (HCl) = 1 + 35,5 = 36,5.
Móltömeg (M) - a súlya 1 mol hatóanyagra vonatkoztatva. Könnyen azt mutatják, hogy a számértékek a moláris tömege, és a relatív molekulatömeg úr egyenlő, de az első érték az alábbi méretekkel rendelkezik [M] = g / mol, és egy második dimenzió:
Ez azt jelenti, hogy a molekulatömeg-hidrogén-klorid egyenlő 36,5 g / mol.
A moláris tömege az anyag gáz halmazállapotú lehet meghatározni fogalmát használva annak moláris térfogata. Ahhoz, hogy megtalálja ebben a kötetben elfoglalt normál körülmények között egy bizonyos anyag tömege, majd kiszámítja a súlya 22,4 liter ez az anyag azonos körülmények között.
E cél elérése érdekében (számítása moláris tömeg) használhatják az ideális gáztörvény (Mengyelejev-Clapeyron egyenlet):
ahol p - Gáz nyomás (Pa), V - a gáz mennyisége (m 3), m - anyag tömege (g), M - moláris tömege anyag (g / mol) T - abszolút hőmérséklet (K), R - az univerzális gázállandó egyenlő 8,314 J / (mol × K).
Példák problémák megoldása
Egyes ezen anyagok tömeghányad oxigén elemen nagyobb, mint: a) cink-oxid (ZnO); b) a magnézium-oxid (MgO)?
Tömeghányada X elem a molekulában HX készítmény kiszámítani a következő képlet:
ω (X) = n × Ar (X) / M (HX) × 100%.
Kiszámítjuk az oxigén tömeg frakció minden eleme az egyes vegyületek (relatív atomtömeg értékeket vett Mendeleev Periódusos Táblázat egész számra kerekítve).
Megtaláljuk a molekulatömege cink-oxid:
Mr (ZnO) = Ar (Zn) + Ar (O);
Mr (ZnO) = 65+ 16 = 81.
Ismeretes, hogy M = úr, azt jelenti, M (ZnO) = 81 g / mol. Ezután a tömeghányada az oxigén a cink-oxid lesz egyenlő:
ω (O) = Ar (O) / M (ZnO) × 100%;
ω (O) = 16/81 × 100% = 19,75%.
Azt találjuk, a molekulatömege magnézium-oxid:
Mr (MgO) = Ar (Mg) + Ar (O);
Mr (MgO) = 24+ 16 = 40.
Ismeretes, hogy M = úr, azt jelenti, M (MgO) = 60 g / mol. Ezután a tömeghányada az oxigén a magnézium-oxid lesz egyenlő:
ω (O) = Ar (O) / M (MgO) × 100%;
ω (O) = 16/40 × 100% = 40%.
Így a tömegrészaránya több oxigén-oxidot, magnézium-, hiszen 40> 19.75.
Tömeghányada X elem a molekulában HX készítmény kiszámítani a következő képlet:
ω (X) = n × Ar (X) / M (HX) × 100%.
Kiszámítjuk az oxigén tömeg frakció minden eleme az egyes vegyületek (relatív atomtömeg értékeket vett Mendeleev Periódusos Táblázat egész számra kerekítve).
Megtaláljuk a molekulatömeg timföld:
Úr (Al2 O3) = 27 + 2 × 3 × 16 = 54 + 48 = 102.
Ismeretes, hogy M = úr, azt jelenti, M (Al2 O3) = 102 g / mol. Ezután a tömeghányada az alumínium-oxid lesz egyenlő:
ω (Al) = 2 x Ar (Al) / M (Al2 O3) × 100%;
ω (Al) = 2 x 27/102 x 100% = 54/102 × 100% = 52,94%.
Azt találjuk, a molekulatömege vas-oxid (III):
Úr (Fe 2O 3) = 56 + 2 × 3 × 16 = 112 + 48 = 160.
Ismeretes, hogy M = úr, azt jelenti, M (Fe 2O 3) = 160 g / mol. Ezután a tömeghányadát vas-oxid lesz egyenlő:
ω (O) = 3 × Ar (O) / M (Fe 2O 3) × 100%;
ω (O) = 3 × 16/160 × 100% = 48/160 × 100% = 30%.
Így a tömeghányadát több fém-oxid az alumínium, mint 52,94> 30.