Vizsgálata vízgőz telítési görbe
Célkitűzés: Ahhoz, hogy ismeri a folyamatok fázisátalakulás anyagból, a koncepció és a párolgási hőt és tulajdonságai; mester technikát a kísérleti tanulmány, vízgőz telítési görbe.
fázisátalakulás folyamatok
Fázisátalakulást úgynevezett átmeneti anyag az egyik fázisból a másikba. Egy és ugyanaz az anyag függően a külső körülmények (nyomás és hőmérséklet) lehet különböző állapotaiban aggregációt.
Az anyag különböző állapotaiban aggregáció eltérő fizikai tulajdonságokkal, és különösen sűrűsége. Ez a különbség azzal magyarázható, természete intermolekuláris kölcsönhatások.
A fázisátmenet a szilárd fázist a gáznemű előforduló nagyon alacsony nyomások, az úgynevezett szublimáció. Hő szublimációs nagyobb, mint a hő olvadék-ment, és a párolgási hőt.
Amikor a fázisátalakulás általában változik hirtelen anyag sűrűsége. Azokban az esetekben, párologtatás és szublimációs a gáz sűrűségének fázis mindig kisebb, mint a sűrűsége a kondenzált fázisban. Ahogy olvadási, itt különböző anyagok különböző eset lehetséges: a sűrűsége a szilárd fázis lehet nagyobb vagy kisebb, mint a sűrűsége a folyékony.
A következő osztályozást fázisátmeneti pontok: átmeneti pont folyadék - gőz nevezett forráspont (amely szintén a pont-TION kondenzátor), az átmeneti ponton, szilárd - folyadék - olvadáspont (megszilárdulási pont azonos), és az átmeneti ponton szilárd-gőz - szublimációs pont.
A fázisátalakulás a görbe pT-löket -diagram állapot, amelyben a három fázis van együtt jelen, füge zitsya-pont (az úgynevezett hármas pontban). A legtöbb jellemző a tiszta anyag egy hármas pont, ahol a szilárd egymás mellett, zsidó-kai és a gőz fázis. A víz hármaspontja megfelel a hőmérsékleten 0,01 ° C, a nyomás pedig 611,7 Pa (0,0062 kg / cm 2).
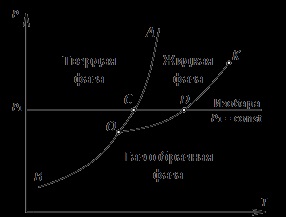
Ábra. 4.1rT - diagram anyag
Ábra. 4.1 ábra egy jelleggörbe pT anyag rajta lerakódott görbék fázisátalakulások. A bal oldalon a vonal AOB egy olyan régió a szilárd halmazállapot. Jobb az RGB vonal egy régió alakú gáz-halmazállapotú anyag, és a sorok között OA és OC # 8210; folyékony régióban. PT A diagramból következik, hogy a vonal egy görbe OB szublimációs anyag, a vonal OA - olvadási görbe (megszilárdulás), és a vonal OK - forrásban lévő görbe (kondenzáció). Forráspont görbe általában nevezik görbe (vagy a vonal) a telítettséget. O pont képviseli a hármas pont, amelynél egy anyag együtt létezik három államban. Curve OB szublimáció folytatódik egészen alacsony hőmérsékleten. OA olvadási görbe felmegy az irányt nagyobb nyomást. OK telítettség vonal végződik K pontot, az úgynevezett kritikus pont. Mivel a tulajdonságok a különböző anyagok különböznek egymástól, és a PT-chart más lesz a különböző anyagok.
Amikor elérte a kritikus paraméterek (hőmérséklet és nyomás) az anyag válik szuperkritikus állapotban. Fent a kritikus paraméterek a kétfázisú állapot nem érhető el. A szuperkritikus állapotban, számos szabad molekulák és a gyengén kötődő klaszterek molekulák. A távolság a részecskék (molekulák és klaszterek) szignifikánsan magasabb, mint a klasszikus folyékony, de sokkal kisebb, mint a hagyományos gáz. Belül a klaszter molekulákat véletlenszerűen vannak elrendezve. A kölcsönhatási energia a molekulák kis csomókban. Ugyanakkor, a sebesség, amellyel az egyes molekulák jönnek klaszterek és hagyja őket nagyon magas. Ezért a rendkívül alacsony viszkozitás és ezzel egyidejűleg a nagy diffúziós a szuperkritikus folyadékkal. A sűrűsége a szuperkritikus folyadék közel van a sűrűsége a folyékony, mely biztosítja a magas oldhatóság. Valamint ezen tulajdonságok az alapja a gyakorlati alkalmazása anyagok szuperkritikus állapotba.
Ábra. 4.1 azt mutatja, hogy a szublimációs vonal és a telítési vonalon pozitív-negatív-tilt. Ez azt jelenti, hogy a növekvő nyomás a fázis átmeneti hőmérséklet (forráspont és szublimációs) növeli. A rendszeresség spraved-Liva az összes ismert tiszta anyagokat. Az olvadási sor különböző vegyületek egyaránt lehetnek pozitív és negatív meredekség.
Pt-diagram (ábra. 4.1) is megmutatja, hogy a halmazállapot a folyamat a fűtési állandó nyomáson. Mozgó mentén izobár p1 = const a régió megfelel a szilárd halmazállapot, olvadási vonal metszi a C pontban - az anyag folyékonnyá válik. A további melegítés metszi telítési vonalon OK ponton D - számít gőzzé alakul át. További haladás az izobár p1 = const felé magasabb hőmérsékleten megfelelő fűtési az anyag a gázfázisban.
Specifikus párolgási hője jelzi a hőmennyiség szükséges átalakításához 1 kg a folyadék gőzzé forrási hőmérsékletén.
Specifikus párolgási hőt határozzuk képlet:
ahol Q - hő mennyisége J; m - tömeg, kg.
Tapasztalati úton talált értékei a specifikus hő párologtatás különböző anyagok és állnak a táblázat. Fajlagos hő párologtatás víz egyenlő 2.257 MJ / kg. Ez azt jelenti, hogy minden kilogramm vizet kell tölteni az energia mennyisége egyenlő 2257 MJ, hogy átalakítsuk azt a gőzt. De meg kell már rendelkeznek a víz forráspontja közötti hőmérsékleten. Ha a víz kezdetben alacsonyabb hőmérsékleten, akkor ki kell számítani a hőmennyiség, amely szükséges a fűtési víz forráspontja.
Kétféle párologtatás: forráspont és párolgás. Forráspont folyamat gyorsan végbemegy a teljes térfogatot a szigorúan meghatározott hőmérséklethez (forráspont). A bepárlási kerül sor, csak a szabad a folyadék felszíne fölötti hőmérsékleten az olvadási hőmérséklet.
száraz telített gőz entalpia i „adja meg:
ahol i „- entalpiája a folyadékot.
A belső energia a száraz telített gőz:
u "= i" - p # 965; „(4.3).
Ahhoz, hogy meghatározzuk a száraz telített gőz nyomás vagy hőmérséklet szükséges ismereteket. Nedves gőz vagy meghatározható P nyomás és a hőmérséklet ti x fokú szárazra pároljuk.
Entalpia ix nedves gőz alábbi egyenlettel határozható meg:
A belső energia nedves gőz ux:
ahol # 965; x - fajlagos térfogata a nedves gőz, amely a meghatározás szerint a térfogatát álló keverék száraz gőz # 965; „, és a víz # 965; " :
Minden nyomás megfelel egy bizonyos forráspontja a folyadék, amely egyidejűleg pár a telítési hőmérséklet Ts. amellyel a folyadék egyensúlyban van.
A kapcsolat a hőmérséklet és a telítési nyomása van kifejezve a Clausius-Clapeyron egyenlet:
mint # 965; „> # 965; " fázisátalakulás „folyadék-gőz”, az alábbiak szerint az egyenletből, az arány - mindig nagyobb, mint nulla, azaz, a hőmérséklet növelésével a telítési nyomása növekszik.
Clausius-Clapeyron egyenlet létrehozza a kapcsolat a nyomás-származékot a hőmérsékletet tekintve, fűtőértékű (r) és a termodinamikai (TH. # 965;”. # 965; „) az anyag tulajdonságaival különböző aggregált államokban.
Probléma 1. Mennyi energia (hő) szükséges gőzzé történő átalakításhoz 2 kg vizet hőmérsékleten t?
1. Adjuk folyamatok: forráspont, párologtatás, párolgás.
2. A folyamat a szublimáció és olvadási.
3. A hármas pont és a kritikus pontot. Szuperkritikus állapotban.
4. meghatározása hője. Clapeyron egyenlet
A kísérleti elrendezés meghatározásához a víz telítési nyomása a hőmérséklettől függően egy kétfázisú régióban a izochor hűtési folyamat ábrán látható. 4.2. Ezzel kapcsolatban, Equation Clapeyron - Clausius számított hő párologtatás r.
A nyomástartó edény 1. tekercselt elektromos fűtőelem 2. intenzíven hűti ventilátor 4. az edényen kívül izolált burkolat 6. automatikus leállítása csapfűtő előírt manométer 7. A nyomás az edényben mérjük nyomásmérő 8. A példakénti különbség, és telítési hőmérsékletek mért környezeti eltérés hőelem 9., hogy kapcsolódik egy galvanométer 10. a berendezésben vannak ellátva egy elektromos fűtőelem ventilátor kapcsol 3 és 5.
Egy zárt, nyomásálló edényben 1 vizet öntünk, ahol a fajlagos térfogat # 965; x kétfázisú rendszer „folyadék - gőz” (a nedves gőz telítési) egyenlő a kritikus érték:
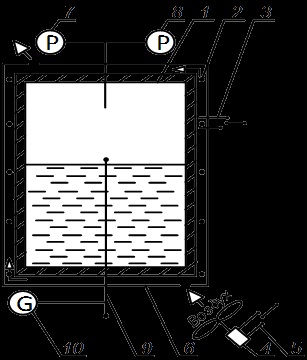
Ábra. 4.2. A kísérleti elrendezés
ahol V - térfogata a teli edénybe rendszer „folyadék - gőz” m 3;
M - tömege „folyadék - gőz” rendszer kg;
# 965; cr - specifikus térfogat a kritikus pont a rendszer, m 3 / kg.
Ennek eredményeként, izochor hűtés (# 965; X = const) mindenkor a rendszer lesz kétfázisú állapotban, kezdve a kritikus pont.
Az eljárás lefolytatására kísérletek
Kezdete előtt a kísérlet lehetővé kell tennie az elektromos fűtés. Amikor elérte a nyomás 220 kgf / cm 2 (37 bar), hogy letiltja, és lehetővé teszi az elektromos ventilátort. További at izochor hűtés „folyadék - gőz” rendszer minden 4 Division írva a táblázatban. 4.4 jelzések példakénti nyomtáv és a galvanométer.
Végén kísérletek (Rizb = 5 bar), hogy letiltja a ventilátor mérésére a Tamb környezeti hőmérséklet, és a légköri nyomáson B. A mérési eredményeket, a táblázatban a kísérleti adatok (táblázat. 4.4).