Valcncy klór (Cl), és példák a általános képletű
Általános információk a klórt vegyérték
A klór a harmadik szakaszban a fő csoport VII (A) alcsoport, a periódusos rendszer.
Szokásos körülményei között klór - gáz sárga-zöld színű. Olvadáspont - 101,0 o C, forráspontja -34,2 ° C-on szerves oldószerben oldható vízben. Lehűtés vizes oldatok kiosztott kristály hidrátok közelítő összetétele hlaratami Cl2 × 6H2 O és Cl2 × 8H2 O.
Klór - aktív oxidálószer.
Klór kétatomos molekula Cl2.
Valcncy klórvegyületek
Klór - figyelembe véve a tizenhetedik eleme a periódusos rendszer D. Mengyelejev. Nem található a harmadik időszak a VIIA csoportban. A sejtmagban klóratom tartalmaz 17 proton és 18 neutront (tömegszáma 35). A klóratom három energia szint, amelyen az elektronok 17 (ábra. 1).
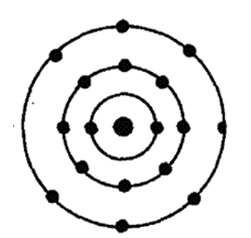
Ábra. 1. Szerkezetek klóratom.
E képlet klóratomok az alapállapotú a következő:
És az energia diagramja (épített csak a külső elektron energia szinten, amely különbözőképpen hívják vegyérték):
A jelenléte egy párosítatlan elektront azt jelzi, hogy a klór képes kifejteni vegyértéke I (a legalacsonyabb vegyérték) annak vegyületek (NaCl I. NaCl I O, Cl I 2 O).
a jelenléte több gerjesztett állapotainak a tényt, hogy a 3D-s pályák -podurovnya betöltetlen (a harmadik réteg mellett az energia és a 3S- 3p-sublevels is alréteg-3d) jellemző klóratom. Először párolt elektronok 3p -podurovnya és elfoglalják a szabad d pályák, és miután - 3s elektronok -podurovnya:
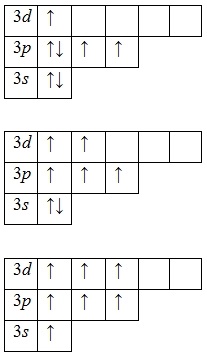
Miután három, öt és hét párosítatlan elektront a gerjesztett állapotban azt jelzi, hogy a klór kiállítási vegyületei vegyértéke III (NaCl III O2), V (KCl V O3) és VI (KCl VII O4. Cl VII 2 O7) (legnagyobb vegyértéket ).
Formálisan klór lehetnek vegyértékű IV (ClO2) és VI (Cl2 O6).