Tissue Engineering
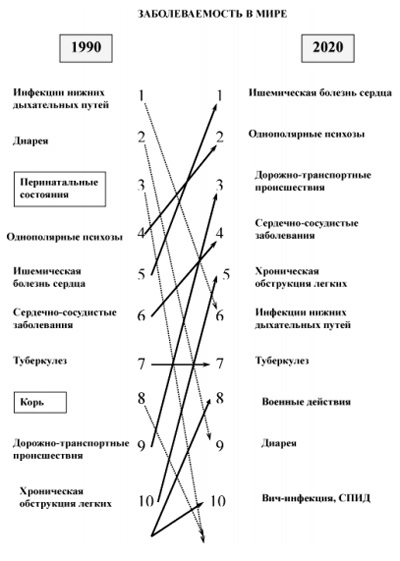
1. ábra A világ jelentése dinamikáját betegségek. Kép [1].
Az utóbbi évtizedekben vált egyértelműen nyilvánvaló zavaró trend az öregedő népesség, egyre több betegség és fogyatékosság a munkaképes korú emberek, hogy sürgősen szüksége van a fejlesztés és bevezetés a klinikai gyakorlatban az új, hatékonyabb és megfizethető módszerek rehabilitációja betegek. Az 1. ábra azt mutatja, hogy a szerkezet a betegség jelenleg.
A mai napig, a tudomány és a technológia számos alternatív módon visszaállítani, vagy cserélje ki a sérült vagy beteg szöveteket és szerveket patológia:
- transzplantáció
- beültetése
- tissue engineering.
Tissue engineering - technológiai újítások
Egy alapvetően új megközelítését - a sejtek és szövetek általában - a legújabb vívmánya a molekuláris és sejtbiológia. Ez a megközelítés megnyitotta széles kilátások a létrehozása a hatékony orvosbiológiai technológia, amellyel meg lehet helyreállítani a sérült szöveteket és szerveket és kezelése számos súlyos metabolikus megbetegedések.
A cél a tissue engineering - tervezés és egyre testén kívül élő, funkcionális szövetek vagy szervek későbbi átültetésre a beteg érdekében, hogy kicseréli vagy serkentik a sérült szövet regenerációja vagy szerv. Más szóval, a háromdimenziós szövet helyreállítandó szerkezetet a helyszínen a hiba.
Fontos megjegyezni, hogy a hagyományos implantátumok inert anyagokat is lehet szüntetni csak a fizikai és mechanikai hátrányait sérült szövet - ellentétben a szöveti kapott mérnöki, amely csökken, beleértve, és biológiai (metabolikus) funkciókat. Azaz, van egy szövetek regenerálódását, ahelyett, hogy egyszerűen helyette egy szintetikus anyagból.
Azonban a fejlesztésére és javítására szolgáló módszerek rekonstruktív orvoslás alapján tissue engineering szükség új rendkívül funkcionális anyagok. Ezeket az anyagokat létrehozásához használt bioimplants, szöveti műtárgyak kell kölcsönöz jellemzőkkel élő szövetekre jellemző:
- képessége, hogy meggyógyítsa magát;
- képes fenntartani vérellátás;
- képes megváltoztatni a szerkezetét és tulajdonságait válaszul a környezeti tényezők, beleértve a mechanikai behatásoktól.
2. ábra: A primer humán sejt. Kép könyvtár Kyokushin Szövetség, Yuzhnouralsk.
A sejteket és mátrixok - egy mérföldkő a tissue engineering
A legfontosabb eleme a siker a rendelkezésre álló szükséges számú funkcionálisan aktív sejtek képesek differenciálódni, fenntartani a megfelelő fenotípus és végre konkrét biológiai funkcióit. A forrás a sejtek lehetnek a test szöveteket és szerveket. Lehetséges használni a megfelelő páciensből származó sejtek szoruló rekonstrukciós terápia, vagy közeli rokon (autológ sejtek). Ott lehet használni különböző eredetű sejtekben, beleértve az elsődleges (ábra. 2) és az őssejtek (ábra. 3).
Ábra 3. emberi őssejtek. Kép: "Living Planet".
Primer sejtek - egy adott szövetben érett sejtek, amely lehet tenni közvetlenül a donor szervezet (ex vivo) sebészetileg. Ha a primer sejtek, melyek egy adott donor szervezet, és ezt követően szükséges implantátum ezeket a sejteket ez, mint a címzett, a valószínűsége a kilökődés a beültetett szövetet eltávolítjuk, mivel a lehető legnagyobb immunológiai kompatibilitását a primer sejt, valamint a címzett. Azonban primer sejtek általában nem képesek megosztani - a kapacitás reprodukciójára és a növekedés alacsony. Az ilyen sejtek szaporításával in vitro (tissue engineering jelenti) az egyes sejttípusok dedifferenciációt, azaz veszteséget konkrét, egyedi tulajdonságokat. Például, kondrocitákat vezetünk a tenyészetbe a testen kívül, gyakran termelnek rostos, és nem átlátszó porc.
Mivel elsődleges sejtek nem képesek osztódni, és elveszíthetik sajátos tulajdonságai, a szükséges alternatív sejtek fejlődését sejt műszaki technológiák. Egy ilyen alternatív, hogy acél őssejtek.

4. ábra: Bio-kerámiából kalcium-ortofoszfát. Kép a portál a csont műtét.
Vezetésére a szervezet növekedésének fenntartásában sejtek differenciálódását a rekonstrukció sérült szöveti sejtek igényel speciális hordozó - mátrix. képviselő egy háromdimenziós hálózat, mint egy szivacs vagy horzsakövet (ábra. 4). Ahhoz, hogy létre őket alkalmazni biológiailag inert szintetikus anyagok, anyagok alapján természetes polimerek (kitozán, alginát, kollagén) és a biokompozitok. Például, ekvivalens a csontszövet kapott irányított differenciálódásának csontvelői őssejtek, köldökzsinór-vérből vagy zsírszövet oszteoblasztokká, melyeket azután a különböző anyagok, az azokat alátámasztó Division (például a donor a csont kollagén mátrix és mtsai.).
"Brand" stratégiája tissue engineering
A mai napig az egyik stratégiák tissue engineering a következő:
- a kiválasztási és termesztése saját vagy donor őssejt;
- fejlesztése egy speciális tápközeg-sejt (mátrix) alapuló biokompatibilis anyagok;
- alkalmazása sejttenyészet mátrix és a sejtek szaporodását bioreaktorban speciális tenyésztési körülmények;
- közvetlen bevezetése a szöveti-mérnöki tervezés, hogy az érintett szervbe vagy előpozícionálást a jól perfundált az éréshez és alkotó mikrokeringést a szerkezeten belül (előregyártás).
Mátrixok idővel a beültetés után egy gazdaszervezet teljesen eltűnnek (attól függően, hogy a szöveti növekedési ráta), de csak az új szövet marad a helyén a hiba. Az is lehetséges, a bevezetése a mátrix a már részben kialakított új szövet ( „biokompozit”). Természetesen, miután a szöveti implantátum tervezés kell őriznie annak szerkezetét és funkcióját annyi ideig helyreállítása normális működését szövet helyén a hiba, és integrálja a környező szöveteket. De, sajnos, a közös mátrixok, amelyek megfelelnek az összes szükséges feltételeket még nem jött létre.
A vérerek a nyomtató
A leendő szöveti sebészetet technológiák megnyitotta a lehetőségét egy laboratóriumi élő szövetek és szervek, de mielőtt az összetett szervek tudomány még mindig tehetetlen. Azonban a közelmúltban, a tudósok által vezetett Dr. Gunther Áruk (Gunter Tovar) a Fraunhofer Társaság Németországban tett óriási áttörést terén a tissue engineering - az általuk kifejlesztett egy technológiát létrehozni ereket. De úgy tűnt, hogy a kapilláris szerkezetét nem lehet mesterségesen létrehozott, hiszen kell hogy legyen rugalmas, hajlékony, kis méretű és egyidejűleg kölcsönhatásba a természetes szövetek. Furcsa, de a termelési technológiák jönnek segíteni - módszer gyors prototípus (más szóval, a 3D-nyomtatás). Magától értetődik, hogy egy komplex háromdimenziós modell (ebben az esetben a véredény) rá van nyomtatva a háromdimenziós tintasugaras nyomtató egy speciális „tinta” (5.).
5. ábra: „nyomtatás” technológia mesterséges vérerek. Kép [6].
A nyomtató okozza az anyag rétegek, és bizonyos helyeken rétegeket csatlakozott kémiailag. Jegyezzük meg, hogy a háromdimenziós nyomtatók mégis elég pontosak a legkisebb hajszálerek. Ebben az összefüggésben azt használja multifoton polimerizációs módszert alkalmazzák a polimer iparban. Rövid intenzív lézerimpulzusok, az anyag feldolgozása gerjesztett molekula annyira, hogy kölcsönhatásba lépnek egymással összekötő hosszú lánc. Ennek megfelelően az anyag polimerizálódik, és képes lesz szilárd, de rugalmas, mint a természetes anyagok. Ezek a reakciók vezérelnek, hogy lehet használni, hogy apró szerkezetek a háromdimenziós „rajz”.
Annak érdekében, hogy a vérerek Dokkolhatja a szervezet sejtjeinek, a gyártása tartályokat vannak integrálva módosított biológiai struktúrákat (például heparin), és „horgony” fehérjék. A következő lépésben a rendszer létrehoz „csövek” rögzített endoteliális sejtek (egyrétegű laphám sejt bélés belső felületén a vérerek) - a vérkomponensek nem ragasztott a falak az érrendszer és a szállítható szabadon rajta.
Azonban, mielőtt igazán lehet beültetni szervek nőtt a laboratóriumban a saját erek, ez némi időt vesz igénybe.
Gyerünk, Magyarország, menjünk!
Anélkül álszerénység mondani, hogy Magyarországon létrehozott egy tudományos alapot gyakorlati alkalmazása az új generációs orvosbiológiai anyagok. Egy érdekes fejlesztési javasolt fiatal tudós Krasnoyarsk Ekaterina Igorevna Shishatskaya (6. ábra) - oldható biokompatibilis polimer Bioplastotan [7]. A lényege, hogy fejlesztési ez magyarázza egyszerűen: „Jelenleg szinte orvosok tapasztalható nagy anyaghiány képes helyettesíteni szegmense az emberi szervezetben. Voltunk képesek szintetizálni különleges anyag, amely képes helyettesíteni az elemek az emberi szervek és szövetek. " Ekaterina Igorevna Fejlesztési fogják használni elsősorban a sebészet. „A legegyszerűbb dolog - ez például varratokat, és készül a polimer feloldódik, miután a seb begyógyul.” - mondja Shishatskaya. - „Azt is, hogy egy speciális betét a hajók - tágítok. Ezek kis üreges csövek, amelyek a kibonthatja a tároló. Egy idő után a műtét után a hajó csökken, és a polimer helyettesítő feloldjuk „[8].

6. ábra nyertese elnöki díját Magyarország Ekaterina Igorevna Shishatskaya. Kép: "KP". [9]

Az első tapasztalatok a transzplantált szövet-mérnöki tervezés a klinika
Ahogy jövőben graft mátrix készült szegmens hullamerevség 7 cm hosszúságú légcsövet. Annak érdekében, hogy a természetes mátrix minden kiváló tulajdonságokat lehet készült polimer csöveken, a légcső-t megtisztítottuk a környező kötőszövettől, és a donor hisztokompatibilitási antigének sejtek. Tisztítása 25 alábbi ciklusból devitalization 4% nátrium--deoksiholata és dezoxiribonukleáz I (folyamat zajlott 6 hét). Miután devitalization minden ciklus zajlott szövettani vizsgálata szövetek kimutatására a fennmaradó mennyiségű magvas sejtek, és az immunhisztokémiai jelenlétére szövet kompatibilitási antigénekkel HLA-ABC, HLA-DR, HLA-DP és HLA-DQ. Mivel a saját bioreaktorba (lásd. Ábra. 9) tudósok felületén egy lassan forgó szegmens a légcső által okozott fecskendővel egyenletes sejtszuszpenziót. Ezután graft, félig elmerül a táptalaj, a tengelye körül forgatják felváltva kapcsolatba a sejteket a közeg és a levegő.
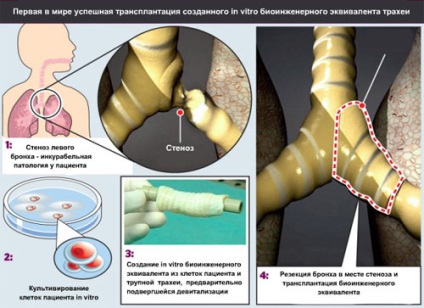
8. ábra: A művelet a transzplantáció a beteg légcső. Kép [10].
Egyenértékű légcső volt 96 óra a bioreaktorban; akkor az átültetett a beteg. Ha a művelet teljesen eltávolították a bal főhörgőt és légcsőrészéből amelyhez tartozott. A kapott különbség vshili graft, és a mismatch átmérőinek lumen bronchus szövet-ekvivalens, és a címzett leküzdése köszönhetően a rugalmassága a szövet donor.
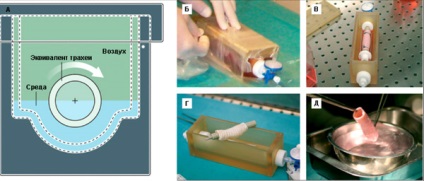
9. ábra A bioreaktor generálására szöveti vetítve légcső. A - bioreaktor rajz oldalnézete. B - tömítő bioreaktor. B - bioreaktorban szöveti vetítve in situ légcsőben. G - bioreaktor eltávolítása után tracheális egyenértékű. D - típusú egyenértékű légcső közvetlenül a műtét előtt. Kép [11].
Tíz nappal a műtét után a beteget elbocsátották a klinikáról nélkül légúti betegség jelei és graft kilökődés immunválaszt. Szerint komputertomográfia, amelyen keresztül a virtuális 3D rekonstrukció légúti szövet vetítve gyakorlatilag megkülönböztethetetlen a beteg saját hörgők készült (ábra. 10).
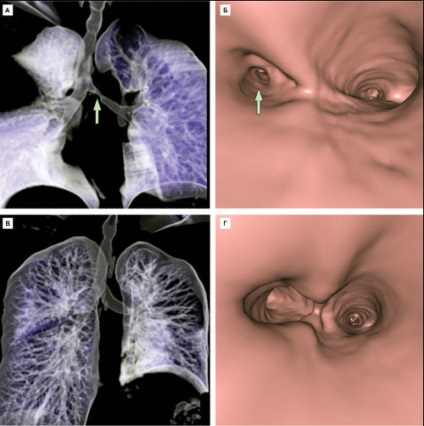
10. ábra A virtuális 3D-rekonstrukció a légutak CT-vizsgálattal és bronchoscopia lépés előtt (A, B), és 1 hónap után a csere a bal főhörgőt stenoticus szöveti vetítve rész (B, D). Nyíl jelzi stenosis. Kép [11].