Számítása a hőmérséklet a folyékony fázisban keveréket rakományok
A hő mindig átment a melegebb test egy kevésbé meleg, más szóval, egy magas hőmérsékletű test - a test alacsony hőmérsékleten.
Tegyük fel, hogy a két anyag kevert képződése nélkül egy kémiai reakció, azaz. E. Nincs felszabadulását vagy felszívódását a hő. Ebben az esetben azt mondhatjuk, hogy a hőt egyenlő a hőt kapott. Ebben az esetben azt feltételezzük, hogy az átviteli környezet hő bekövetkezik.
A hő, amely át az egyik anyagot a másik a keverés folyamán, hő érkezik egy másik anyaggal.
Más szóval, a hőhordozó fog bekövetkezni, amíg az anyag hőmérséklete nem egyenlő.
Ez a meghatározás, a gyakorlatban használható szállításakor a cseppfolyósított gáz propán és bután különböző kapacitású és különböző hőmérsékleteken keveredve a fedélzeten.
Ebben az esetben tudjuk számítani előre a hőmérséklet keverékéből cseppfolyósított gázok, ismerve a kezdeti paraméterek az egyes gázok keverés előtt őket. És ismerve a keverék hőmérséklete, tudjuk meg a nyomás a tartályban, és a sűrűsége a rakomány.
Először is, írunk formájában a képlet már ismert egyenlőség - megegyezik a hő által kapott hőt adott el:
ahol a bal fele a egyenlet határozza meg, a meleg folyadék, és a jobb - a meleget a többi. Most egyszerűen ez lehet tekinteni, mint egy példát.
Példa: össze 5 kg propán hőmérsékleten tp = -40 ° C, és 8 kg bután hőmérsékleten TB = 2 ° C-on A fajhője propán cp = 2476 J / kg K, és a bután cb = 2366 J / kg K Mi határozza meg a keverék hőmérséklete Tm gázokat.
Megoldás: Egyértelmű, hogy a Tb> Tm> Tp, és lehet írni a propán
A mi esetünkben,
ΔTp = (Tm - 233); ΔTb = (275 - Tm). Számítsuk ki a keverék hőmérséklete képlet szerint (1):
• MP = cp ΔTp cb = MB • • ΔTb = 5 • 2476 • (Tm -233) = 8 • 2366 • (275 - Tm) • Tm = 12.380-2.884.540 =
= 5205200-18928 • 31308 • Ez Tm Tm = 8089740 vagy
Tm = 258,39 = 8.089.740 = 258,4-273 = -14,6 ° C
Az általános esetben a számítás a keverék hőmérséklete fejezhető ki képlettel:
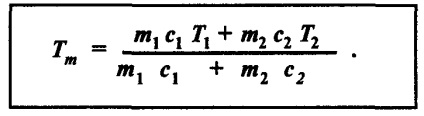
Dalton-törvény a következőképpen fejezhető ki:
ahol a Pt - teljes nyomás a gázelegy; pA + pB - parciális nyomása az egyes gázok; NA - móljainak a száma a gáz egy, a képernyőn; nA - móljainak a száma a gáz a mennyiség; R- egyetemes gázállandó egyenlő 8,314 J / (mol • K); T - abszolút hőmérséklete a gáz keverék; V- térfogatarányú elegyét gázok m3.
A nyomás a gázelegy az összege a parciális nyomások az egyes gázok alkotó keverék.
A parciális nyomás - egy tiszta gáznyomás (adalékok nélkül) egy adott térfogatban egy előre meghatározott hőmérsékletre.
Kiszámításához a tömeg fogalmának a keverék koncentrációja gáznyomást alkalmazunk g i és moláris koncentrációja a gáz ri,
ahol GiiGcm- gáz tömege és a tömeg a gázkeverék; niincm- anyagmennyiség gáz és a gázkeverék (mol).
Szállításakor keveréke cseppfolyósított gázok fontos tudni, mekkora nyomás lesz a tartályban adott hőmérsékleten. Erre azért van szükség paramétereinek meghatározására egy kompresszor telepítést.
Tekintsünk egy néhány egyszerű számítási módszereit gőznyomás, ha ismert moláris összetétele a keverék vagy tömeg betöltött fedélzetén.
Példa: A hajót víz alá gázkeverék, amely 100 tonna és 400 tonna propán-bután keverék hőmérsékletét -8 ° C-on (lásd a számítás a gáz hőmérséklete keverék.). Telített propán gőznyomás ezen a hőmérsékleten egy bizonyos grafikus vagy vett táblázatok 3,69 bar. A bután gőznyomás ugyanazon a hőmérsékleten 0,78 bar. Meg kell, hogy meghatározza a nyomás a telített gőz elegy (térf. E. A teljes nyomás a tartályban), és a százalékos összetételét a gázfázis a folyadék felszíne feletti.
Megoldás: Számítsuk ki a mólarány a propán és bután a keverékben. Erre a célra határozzák moltömegére-nek propán és bután C3H8 C4H10. A periódusos rendszer, azt találjuk, hogy az egyik szénatom van egy tömege 12,01115 g / mol, és a hidrogénatom - 1,00797 g / mol.
Ezután a moláris tömege propán 12,01115 g / mol x 3 = 36,03345 g / mol
1,00797 g / mol x 8 = 8,06376 g / mol s
44,09721 g / mol = 44,1 g / mol;
móltömeg bután 12,01115 g / mol x 4 = 48,0446 g / mol