Recovery - Chemical Encyclopedia
Redukálószer. Szigeteknek az elektront leadó a okislit.-visszaállítás. p-TIONS. Rel. helyreállítása. hogy két, vagy több-ben határozzuk meg, hogy összehasonlítjuk a változás a Gibbs energia p-TIONS ilyen in-one ugyanabban oxidáló. és abban az esetben p-TIONS egy egyszerű-a - Gibbs képződési energiája oxidációs termékek az egyszerű-va (oxidok, halogenidek és hasonlók.). A többé-absz. érték, annál aktívabb redukálószer van jelen mennyiségben. úgy, hogy normál körülmények között a p-TIONS mM'Fn nM + -> nMFm + mM'kaltsy - aktívabb redukálószer fém-fluoridokat (CaF2 kapcsolódó egy fluoratomot - .. 584,2 kJ / mol), mint Mg (-535 5 kJ / mól) és az A1 (-477,1 kJ / mól), de kevésbé aktív, mint a Li (LIF - 588,0 kJ / mól). Abban az esetben, elektrokémiai. p-lítása során az összehasonlítás visszaállítani. -in képesség, hogy egy standardpotenciál E °. Minél több abszolút. E ° értéke fele reakció behajtásával járó egy-szigetek, annál erősebb lesz letölteni kommunikációs Önt ebben a mennyiséget.
Tartozni erős redukálószer és lúgos schel.-földet. fémek. Al, Si, C, H 2 és számos al., Egy egyszerű, fém-hidridek és comp. tartalmazó nemfémek a otritsat. oxidációs állapotban (és mások.). Nagyon erős, hogy visszaszerezze. rendelkeznek azzal a képességgel, hogy p-ry tartalmazó svob. vagy szolvatált elektronok. pl. p-ry ammónium-, alkálifém- schel.-földet. fémek (lásd. ammónia) és atomos hidrogén.
Vannak a szigeteken, hogy rozs ugyanabban okislit.-visszaállítás. p-CIÓ egyaránt redukáló szerek és oxidáiószerek. Egy ilyen molekula, tartalmazza az atomok. és az összekötő donor elektronok. pl.
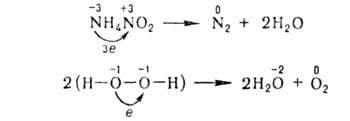
===
App. Irodalom a cikk „redukálószer.” Ezután b ML mechanizmusai szervetlen reakciók. per. az angol. M. 1975. p. 181-82. E. G. Rakov. B. D. Stepin.
