Protrombin komplex - vegyi enciklopédia
Protrombin komplex. Csoport glycopril-Thein plazmában. beleértve a véralvadási faktorok-II (protrombin), VII, IX és X, valamint a szabályozási SI és S-proteinek, to- vegyenek a központ. hivatkoznak egymás színpadon. p-TIONS aktiválását prekurzor fehérjék képződéséhez vezet a trombin.

A fehérjék a protrombin komplex (lásd. Táblázat.) Jellemzi homológiát primer és tercier struktúrákat, bioszintézis, és közös mechanizmusok az aktiválás a mindenkori aktív formáit, a IIa (trombin), VIIa. IXa. Ha és fehérje Cia. Protrombin komplex proteinek szintetizálódnak a májban, és mennek keresztül módosítása postribosomal-nek a mikroszómákban előtt szekréció a vérbe. A módosítást úgy vezérli a K-vitamin 10-12 karboxilezése glutaminsav-a meg a N-terminális régió az egyes fehérjék alkotnak maradékok g -karboksiglutaminovoy a-te. Az egyenlegek biztosítja a képességét, hogy kötődnek proteinek a protrombin komplex ionok Ca + 2. keresztül to- történik kapcsolódási fehérjék, hogy a negatív töltésű foszfolipidek dressing-STI sejtmembránok. Binding szükséges koncentrálni a protrombin komplex fehérjék, elérni a magas áramlási sebességek egymás után. r-TIONS és kaszkád szabályozás.
K-vitamin-hiány, vagy beadását annak antagonisták (pl. Bishydroxycoumarin) csökkenéséhez vezet, vagy teljes gátlását a vitamin-dependens p-CIÓ karboxilezéséhez glutaminmaradékok-te. Ennek eredményeként, hibás képződését a protrombin komplex fehérjék, és csökken a vér alvadási. A protrombin komplex fehérjék, kivéve a protrombin. talált kis józan az élő szervezetekben b -gidroksiasparaginovaya-egy funktsion. értékét egy raj nem tisztázott. Ismert elsődleges szerkezete a fehérjék a protrombin komplex és izolált gének. kódoló bioszintézisük.
Aktív formák protrombin komplex fehérjék alkotják egy sor új-proteolitich. enzimeket. kell-ryh katalitich. része az aktív hely található a C-terminális régiója a nehéz lánc molekulával. Az aktiválás után, proenzim (ami megszüntetése peptidfragmensek) C con tsevaya területen enzim kötve marad az N-terminális domén diszulfid kötés. miáltal végzett optimális tájolását a fehérjék a sejtmembránon. Kivétel-trombin enzim. to-nek eredményeként a protrombin aktiválását veszít tartományban. tartalmazó Ca2 + -kötő helyek.
Katalitich. Holy Island enzimek fokozott által Comp leksoobrazovaniya a szabályozó fehérjék, vagy kofaktorok abrancsok STI sejtmembránok. Ezek közé tartozik: Faktor-VIII-kofaktor IXa faktor. Az V faktor kofaktor Xa faktor. szöveti faktor (TF) - kofaktor VIIa faktor. protein-S és a trombomodulin - Sia kofaktor fehérje. Knob-WIDE fehérjék optimális helyen, közel a megfelelő enzimek szubsztrátjai. ezáltal proenzimeket, aktiválás sebességét növeljük tízezer vagy több alkalommal.
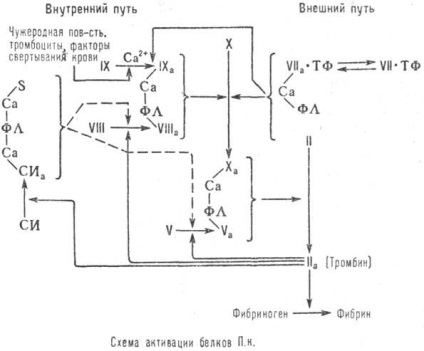
A mechanizmus a protrombin komplex fehérjék (lásd. Ábra) tartalmazza a külső. path, egy rum-részt szöveti faktor-lipopro-tein, által alkotott szöveti károsodás. és a belső. A szilárd nyilak az ábrán mutatják aktivációs útvonalat a protrombin komplex fehérjék, szaggatott útját gátlása ebben a folyamatban (PL - foszfolipidek a sejtmembrán). A trombin részt vesz az utolsó lépés a vérrög aktiválása révén az átalakítás a fibrinogén fibrinné.
Irod Vándor L. Biokémia. per. az angol. Vol. 1, M. 1984. o. 152-76; Jackson, Nemerson Y. "Ann. Rev. Biochem.", 1980, v. 49, p. 765-811.