Ozmózis, ozmózis nyomás, moláris koncentrációja
Ozmózis úgynevezett spontán mozgása az oldószer egy membránon keresztül permeábilis az oldószer és átjárhatatlan az oldott anyag (féligáteresztő hártya) a kevésbé tömény oldatot több koncentrált.
Minden esetben a figyelembe vesszük az oldószer fog működni, mint a víz. Így a víz mozog, ahol a nagyobb (kevésbé koncentrált oldat), ahol ez kisebb, (töményebb oldat). Ozmotikus folyamatok zajlanak jelenlétében egy féligáteresztő membrán permeábilis csak az oldószer - víz. féligáteresztő membránok jelenléte miatt a benne bizonyos tulajdonságai és méretű, miáltal a molekula néhány tulajdonságok és dimenziók áthatolnak, és a másik - nem hatolnak. Fontos, hogy ne csak a méret a molekulák, de a fizikai és kémiai tulajdonságok, így lehetséges, hogy a nagyobb molekulák áthaladnak a membránon és a kisebb - nem fog működni. Mivel gyakorlatilag az összes membrántest - félig áteresztő, az ozmotikus folyamatokat ez meghatározza annak teljes élettartama aktivitását.
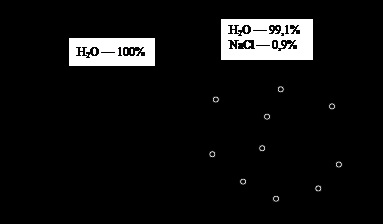
Ábra. 2. ozmózis. Magyarázatok a szövegben
Ozmózis ábrák leírják egy egyszerű kísérlet (ábra. 2). Vegyük az injekciós üveg desztillált vízzel és elosztjuk egy féligáteresztő membrán két egyenlő részre. Természetesen, ez nem okoz semmilyen új jelenségek az edényben, mint mindkét oldalán a membrán oldószer önmagában. Oldható bármely részén az edény egy anyag (a határozottsága, legyen egy fiziológiás nátrium-klorid koncentrációja - ≈ 0,9%). Mindkét oldalán a membrán keletkezik koncentrációgradiens létező hajó anyagok: víz és nátrium-klorid. Ez természetes, hogy feltételezzük, hogy, hogy megkezdi a spontán összekeveredése anyagok vezetnek a szintező a koncentráció mindkét felét a hajó. Azonban, a félig-áteresztő membrán nem adja át az oldott anyag, és nem tud mozogni egy hely, egy nagyobb koncentrációban, ahol a koncentráció kisebb, mint (a mi esetünkben - nulla). Ezért, a lépés csak vizet - egy olyan helyről, ahol nagyobb (100% koncentráció), egy olyan helyen, ahol ez kisebb, (≈ 99,1%). Meddig lesz a folyamat? A kísérlet azt demonstrálja meggyőzően bizonyítja, hogy végül megáll a víz mozgását, és meg kell találni, hogy miért. Ahhoz, hogy ezt elérjük, végezze el a következő érvelés.
Ahogy a víz mozog, ott kell lennie valamilyen erő mozgásba hozza azt. Ha a mozgás leáll, az azt jelenti, hogy van egy másik, ami egyenlő nagyságú és ellentétes irányú, az erő, amely megakadályozza a folytatása a mozgás. Mi ez az erő? Ábrára hivatkozva. 3.
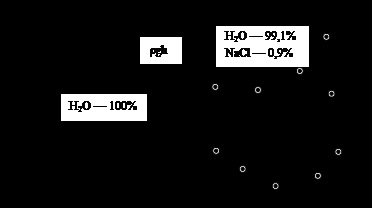
Ábra. 3. ozmózis. Magyarázatok a szövegben
A folyamat során a mozgó a folyadék szintje az oldószer a bal oldali részén a szám csökken, és a megfelelő - például a sokat javult. Ez vezet a különbség hidrosztatikus nyomás mindkét felét a hajó egyenlő # 961; gh, ahol h - magasság különbség a folyadék oszlopok a két rész a hajó. Amikor h értéket eléri, amely a nyomás megegyezik, és ellentétes irányú nyomóerők vezetés az oldószert a membránon keresztül, a mozgás megáll. A nagysága ezt a nyomást megegyezik az ozmotikus nyomás a megoldás, hogy a jobb oldalán a hajó. Ha azt akarjuk, hogy azonnal megakadályozza oldószert transzfer a membránon keresztül, szükséges lenne alkalmazni oldatot (jobb felét a hajó) egy nyomás megegyezik az ozmotikus nyomás az oldat (ábra. 4).
A ozmotikus nyomás az oldat egyenlő a nyomást kell alkalmazni, hogy a megoldás, hogy megakadályozzák mozgását ott tiszta oldószerrel.
Az ozmotikus nyomást lehet meghatározása a következő:
az a nyomás, amelynél oldószert behatol az oldatot a féligáteresztő membránon keresztül.
Természetesen, az ozmotikus nyomást érzékeli csak jelenlétében áteresztő membrán csak az oldószert.
Mint minden nyomás, az ozmotikus nyomást lehet mérni a légkörben. Hgmm. Art. Pascal. mm víz. Art. stb Azonban nem minden ilyen egység könnyen használható. Így, az ozmotikus vérnyomás kifejezett atmoszféra, átlagok 6,62 atm. (Természetesen izoozmoláris jog, azonos nyomás más ágazatokban a szervezetben). Ezért, más mértékegységben választottuk expressziója ozmotikus nyomás. Mielőtt megismerni őt, leírjuk egy másik kísérletet.
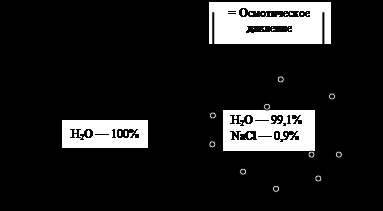
Ábra. 4. ozmózis. Magyarázat a szövegben
Tekintsük ismét a hajó, kétfelé osztottunk egy féligáteresztő membrán, amelynek egyik oldalán volt a fiziológiás nátrium-klorid-oldattal, és oldódik egy másik része, például a glükóz és 5,5% (pontosabban - a 5.544%) koncentrációban (5. ábra).
Annak ellenére, hogy a koncentrációk közötti különbség anyagok mindkét oldalán a membrán, mozgását az oldószer (víz) nem figyelhető meg, mivel bőven azt a kísérletben [1]. A mozgás hiánya az oldószer azt jelenti, hogy ozmotikus nyomás az oldat mindkét oldalán a membrán azonos, bár tömegük sűrűsége, ezért sűrűsége, eltérő. Ezért az ilyen kifejezési módja a koncentráció (térfogat százalékban) nem tükrözik az ozmotikus nyomás az oldat.
Azt már régóta a különböző fizikai és kémiai kutatási megoldásokat bebizonyították, hogy az ozmotikus nyomás függ kizárólag a számát oldott részecskék (molekulák, ionok) és nem függ azok tulajdonságait (méret, tömeg, elektromos töltés, stb). Tehát szükségünk van egy egység, amely tükrözi a részecskék mennyisége. Egy ilyen egység a mol. 1 mól bármely anyag tömege, grammban kifejezve, számszerűen egyenlő a molekulatömeg az anyag, amely megtalálható a keresett a periódusos. Például, 1 mól szén-tömege 12 g, a vas - 56 g, oxigén - 32 g (16 + 16, mivel az O2 molekula két atom). A nehezebb a részecske (molekula), 1 mol a keményebb anyag, hajtogatott ezekből a részecskékből (molekulák). De a leginkább figyelemre méltó olyan ez az egység, hogy 1 mól bármely anyag tartalmazza az azonos molekulák számának egyenlő ≈ 6,02 # 8729 október 23. (Avogadro számát). Ezért nyilvánvaló, hogy mivel az ozmotikus nyomás az oldat számától függ az oldott részecskék, és ezt a mennyiséget kifejezhetjük a mólszáma anyag, az ozmotikus nyomást lehet (és kényelmes!), Hogy kifejezzék egy moláris koncentrációja oldatot (ozmolaritás).
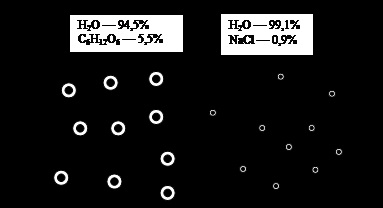
Ábra. 5. Osmos. Magyarázatok a szövegben
A ozmotikus nyomás a vér, kifejezett moláris koncentrációja 300 mmol / l, változó 285-310 mmol / l. Ez az érték rendkívül fontos, és a test hajlamos fenntartani azt a meglehetősen szűk határok. Feltételeket, amelyek az ozmolaritás csökken fogunk hívni gipoosmolyarnymi, és amelynek értelmében emelkedik - hyperosmolaris. Ozmolaritásmérések, valamint rengeteg egyéb mutatók, szoros figyelemmel kell kísérni az intenzív megfigyelés. Meg lehet mérni közvetlenül ozmométert, és lehet becsülni számítással.
A működési elve a ozmométert alapján a következő fizikai tény. A készítményekben az oldott részecskék nemcsak egyedileg azonosítja az ozmotikus nyomás, de a fagyáspont, és a forrásban lévő oldathoz. Minél magasabb az ozmolalitás, az alacsonyabb a fagyáspont és forráspontja az oldat felett. Fagyáspont ozmométer méri a biológiai folyadék, hogy vizes. Ez a hőmérséklet mindig kisebb, mint 0 ° C-on Minden fagyasztás egyedileg megfelel egy bizonyos moláris koncentrációja az oldat, azaz annak ozmózisnyomás (függetlenül a minőségi összetételét az oldatban).
A becsült ozmolaritása számítási módszer, nézzük meg a következő részben.