ozmotikus nyomás
A természetben, az oldatokat gyakran elválasztva áteresztő membrán tetőfedő-az oldószer molekulák. Ezekben az esetekben a kettő között van az NE-Lenie úgynevezett ozmózis. Ozmózis - spontán infiltrációs az oldószer-molekulák a membránon keresztül egy oldószeres oldat, vagy egy alacsony koncentrációról oldatot egy megoldást a magasabb az anyag koncentrációja.
Az előfordulása ozmózis szükséges megoldások különböző koncentrációjú hozzuk érintkezésbe keresztül egy féligáteresztő membrán, amelynek szerepe a vizes oldatok tud végezni, mint állati és növényi membrán (köpeny szarvasmarha húgyhólyag, bél falán, sejtmembránok), és a mesterséges membránok (kollódiumban film, celofán, ferro réz).
A legegyszerűbb módszer mérésére megakadályozza a túlzott hidrosztatikus-MENT ábrán mutatjuk be 1.6.
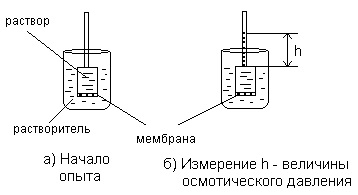
Ábra. 1.6. Mérése feleslegben hidrosztatikus nyomás
A magasság a folyadékoszlop a hengeres cső egység (keresztmetszeti területe hozott egyenlő 1 cm 2), amelynél a dinamikus egyensúlyi állapot jön létre, meghatározza az ozmotikus nyomás az oldat.
Ozmotikus nyomás egyenesen arányos a molekulák számát, vagy kolloid részecskéket egységben foglalt térfogatú oldat, azaz ez egyenesen arányos a koncentrációja az oldat. Továbbá, az ozmotikus nyomás egyenesen arányos a hőmérséklet. Van't Hoff egyesült a két mintát, csökkentve őket egy általános képletű (van't Hoff-egyenletből):
π - ozmózisnyomás;
c - az oldat koncentrációja mol / l;
R - tényező az arányosság (univerzális gáz
Ha a koncentrációja az oldat 1 mol / l, szerint a van't Hoff-törvény ozmotikus nyomása az oldat O ° C-on egyenlő:
Π = 0,082. 273 = 22,4 atm.
Ha figyelembe vesszük, hogy a kolloid részecskék sokszor nagyobb, mint a részecskék valódi oldatokat, majd az azonos súly szerinti koncentrációja ezek a megoldások egységnyi térfogatú a szol részecskék jóval kevesebbet tartalmaz, mint az azonos mennyiségű valódi oldat. Következésképpen az ozmotikus nyomás a szolok nagyon kicsi azokkal szemben, az igazi megoldásokat. Így, az ozmotikus nyomás egy 1% -os glükóz oldatot egyenlő 509 mm higany-láb oszlop, míg a nyomás a 1% szol arzén-oxid (As2 O3) - 0,026 mm Hg. Art.
Példa. Számítsuk ki az ozmotikus nyomás 0,5 M szacharóz-oldatban 37 ° C-on
Ozmotikus nyomás az alábbi képlettel számítottuk ki:
π = 0,5. 0.082. (273 + 37) = 0,5. 0.082. 310 = 12,7 (atm.)
Ezen túlmenően, a szolok nagyon kis mértékben csökken az arány-mérséklet emelkedése fagyasztás és forráspontja, mint ezekkel a tulajdonságokkal az igazi megoldásokat.
A biológiai jelentősége a jelenség az ozmózis
Ozmózis előfordulhat hidratációját sejtek ad nekik alakja, turgor okok, segít megőrizni a rugalmasságát és ellenálló képességét. A víz nélkülözhetetlen a sejt reakciókat több -. A hidrolízist, hidratáció, oxidáció, stb sejtmembránok a nátrium- és kálium-ionok nem áteresztő (vannak „szivattyúk” újra-orr a membránon keresztül).
Ha az ozmotikus nyomás az oldat egyenlő, hogy a standard oldat, ez a megoldás az úgynevezett izotóniás; Ha a folyadék nyomása nagyobb, mint a standard nyomáson az oldat, az oldat hipertóniás, és ha ez kevesebb, mint a nyomás a standard oldat - hipotóniás oldat. A standard oldatot kell tekinteni testfolyadék rendszerek. Vér, nyirok, a szöveti folyadék - vizes oldatai sok különböző molekulák és ionok. A teljes ozmózisnyomás-beállított 37 ° C-on egyenlő 7,7 atm. amely hozzájárul a megfelelő hidratálást a sejtek és az intercelluláris struktúrák és a normál áramlását a különböző fizikai és kémiai folyamatok. Ugyanez nyomás 0,9% (vagy 0,15 M) nátrium-klorid oldattal. Ez a megoldás az úgynevezett fiziológiás. Most, hogy további sók, fehérjék, stb
Ha élő sejteket helyezünk hipotóniás oldatban, például intézkedések a vízben, megduzzad bejutását a vízmolekulákat, és tört. Ezt a jelenséget nevezik lízis. Abban az esetben, vörösvérsejt lízis hívták hemolízist, mint ugyanakkor a ketrecből ki haemo-globin, és a víz pirosra vált,
A hipertóniás oldatok a víz, éppen ellenkezőleg, elhagyja a cellát, és zsugorodik. Ez a jelenség - plazmalizálódnak.
A magasabb rendű állatok és az ember-ozmotikus így Lenie nagyon következetesen. Ezt a jelenséget nevezzük izoosmiey azt WMO-dit a fogalom homeosztázis. Leengedése az ozmózisnyomás által a bevezetése nagy mennyiségű víz vagy eredményeként intenzív-ter-sók a verejték, a vizelet okozhat hányást, görcsöket, sőt halált.
Növelik az ozmotikus nyomás bevezetésével nagy coli kitüntetéssel sók újraelosztását eredményezi sók. Víz összegyűlik Xia azokban a szövetekben, ahol a letétbe helyezett összeget a felesleges sókat, okozva duzzadási, míg kiszáradás a nyálkahártyák okoz szomjúság, megzavarja a normális működését az idegrendszer és más szervekben.