nitrogénvegyületek
Ennek része a molekulának négy pirrolgyűrűhöz. A porfirinek nagyon hajlamos a kialakulását komplex vegyületek fémekkel. A olajok azok mind szabad állapotban, és a komplexek formájában vanádium, nikkel és vas.
Kémiai tulajdonságait nitrogéntartalmú vegyületek a) az alap (lúgos) vegyület
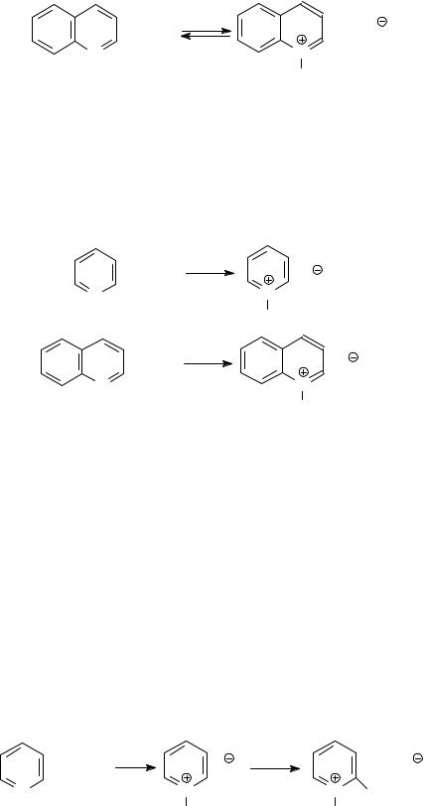
Piridint lehet tekinteni, mint a benzol, amelyben a csoport -CH = helyettesített nitrogénatom. És a piridin, és a benzol olyan molekulák, amelyek lényegében szabályos hatszög.
A jelenléte a nitrogénatom magányos elektronpár vezet az a tény, hogy a piridin (és egyéb nitrogéntartalmú bázisok - kinolin, izokinolin, akridin) tulajdonságait mutatják tercier aminok. Először is, ez a tulajdonságait gyenge bázisok. Az oldatban reagálnak a víz a fő
A koncentrációkat a hidroxil ionok elegendő legyen a különböző hidroxidok fémek: Fe 3+. Co 2+. Sn 2+ és más.
A találmány szerinti vegyületek könnyen alkotnak sókat savakkal, például hidrogén-kloriddal, hidrogén-bromid, kénsav és mások:
H -piridinium-bromid
Sók jól kristályosítjuk és használt izolálására és azonosítására nitrogénvegyületek. Érdekes, akridin sók vizes oldatok van zöld fluoreszcenciát, és a hígítás során hidrolízissel fluoreszcencia továbblép egy kék jellemző szabad akridinium.
Ahogy a tercier aminok, a nitrogéntartalmú bázis reagálnak alkil-halogenidekkel reagáltatva a megfelelő sót, amelyek melegítés eredményeként az átmenet izomerizált szubsztituens a nitrogénatomon a-helyzetű szénatom 2 vagy 4 (de nem 3):
Feldolgozása során hidrogén-peroxid és a perbenzoesav, a nitrogén-oxidok vegyületek képződnek az ecetsavas közegben:
A piridin-mag van jelen a molekulák az említett nitrogén-bázisok, vetjük alá, hogy elektrofil szubsztitúciós, nukleofil, gyökös reagensek. Meg kell jegyeznünk, hogy a jelenléte kimeríti gyűrűs nitrogénatom elektronsűrűség miatt erős pozitív indukciós hatás, és különösen a kimerült helyzetben 2,4,6. A jelenléte-alkil- vagy egyéb donor szubsztituensek elősegítik elektrofil szubsztitúciós reakció.
Hevitésre piridin 24 órán füstölgő kénsav segítségével 220-230 ° C-on jelenlétében higany-szulfát képződik piridin-3-
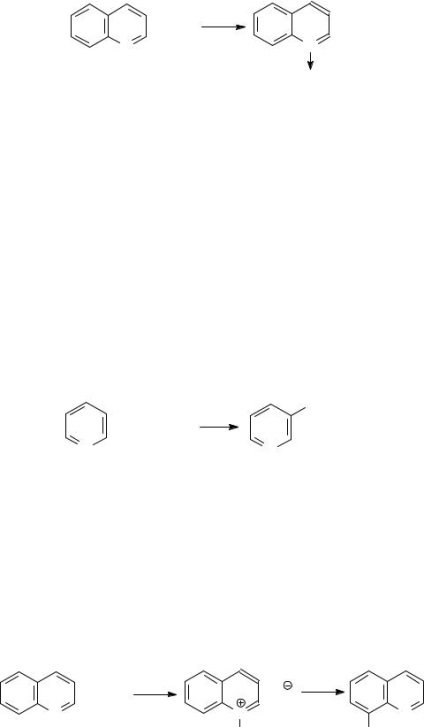
A kinolin vagy akridin ciklusok, amellett, hogy a piridin, benzol gyűrű van jelen, annál aktívabb a szubsztitúciós reakciók. Ezért szubsztitúciós reakciókat eljárni ezek a vegyületek sokkal könnyebb.
Ez indukciós hatás kinolin nitrogénatommal vezet kimerülése elektronsűrűség 2,4 helyzetűek a piridin és az 5,7 - benzolgyűrű. Ezért elektrofil reagensek megtámadják elsősorban rendelkezéseinek 8.6:
Az általános reakciót a nitrogéntartalmú vegyületektől, hogy képesek visszaállítani a hidrogén:
b) Semleges nitrogéntartalmú vegyületek
Ezekben a vegyületekben közölt egy öt tagú gyűrű a nitrogénatommal állapotban sp3 hibridizációs amelynek hidrogénatom. az
a kialakulását az aromás elektron rendszer magában foglalja mind a 4 π-
elektron két C = C kötés, és az osztatlan elektronpár a nitrogénatom,
amelyek kialakulásához vezet egyetlen shestielektronnogo π-felhő - aromás szerkezete hasonló a benzol. Ennek eredményeként, a pirrol gyűrű lapos, egyszeres kötések megrövidülnek. A szerkezet a pirrol gyűrű képviselt reakcióvázlaton (kötéshossz jelzett angström).
semleges vegyület
kölcsönhatás aktív redukáló szerek, például,
fém kálium, vagy Grignard-reagenst.
Amikor kondenzált pirrol száraz kálium-hidroxid és
hajtjuk hidrogénatom helyettesítés és kialakulását pirrolkaliya:
Pirrolkaly (! De nem a pirrol) reagál alkil-halogenidek, például etil-jodid, így kapjuk a helyettesített pirrolok:

Alapvető tulajdonságait pirrol, amely formálisan szekunder amin elfedi gyors polimerizáció alatt sav hatására.
Egy érdekes kvalitatív reakciója -pirrolt bőrpír fenyő zseblámpa megnedvesített sósavval, jelenlétében pirrol gőzök. Feltételezzük, hogy ennek oka, hogy a polimerizációs pirrol savas környezetben.
Pirrol könnyen hidrogénnel redukált:
A letöltés folytatásához össze kell rakni egy képet: