Nátrium (nátrium) - tudom, hogyan
Nátrium (Natrium); al. Tömeg 22,991. Mint már jeleztük, vagy fémes nátriumot úgy kapjuk elektrolízisével olvadt nátriumhidroxiddal, majd az oldathoz hozzáadtunk körülbelül 12% szódát, vagy nátrium-klorid elektrolízisével.
Készülék előkészítése a nátrium-hidroxid-oldatot ábrán látható. 140. Vas edény 1 befogadására képes 200 kg NaOH és vmazat a kemence fűtött kívülről fűtött gázokat, hogy fenntartsák a nátrium-hidroxid olvadt állapotban. Vastag katód nikkel vagy réz rúd 2 áthaladó edényfenék, az anód - katód nikkel 3 henger körül egy vas rács fölött halad át a vas 4 henger, zárt fedéllel. mesh Cél -, hogy megakadályozzák a behatolást a nátrium kibocsátott az anód.
Az elektrolizáló eljárás, olvadt vas nátrium halmozódik a henger belsejében, ahol periodikusan scooped és öntött formába.
Az anódon oxigén fejlődik miatt a mentesítés a hidroxil ionok.
Az így kapott víz elpárolog csaknem teljes egészében, de ennek ellenére néhány bomlik aktuális, miáltal a katód szabadul egyidejűleg a nátrium és hidrogén.
A nagy érdeklődés van a készítmény nátrium-olvadék lennogo nátrium-klorid, hiszen ebben az esetben a nátronlúg helyébe drága sokkal olcsóbb terméket - az asztali só.
Bath elektrolízises NaCl (ábra. 141) áll, egy vas 1 köpeny, eltakarja a belsejében tűzálló téglákkal. Grafit anódot 2 körül egy nikkel 3 katód, a külső falak vannak bevonva elektromosan szigetelő anyagból. A harang 4 hálós terelő 5, amely a katód. Fémnátriumot összegyűjtjük a gyűrűs térben, és a katód csövön keresztül 6 bemegy kollektor 7. A nátrium-kloridot bemérünk a lyukon keresztül a fedél fürdőben.
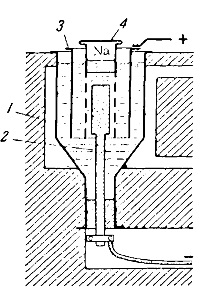
Ábra. 140. Berendezés fém nátrium NaOH: 1 - reakcióedénybe; 2 - a katód; 3 - egy anód; 4 - vas henger háló és fedelet
A módszer hátránya, hogy szükség van, hogy az eljárás kivitelezéséhez viszonylag magas hőmérsékleten (610-650 ° C), amely előírja, meglehetősen bonyolult berendezés szükséges.
A szabad állapotban nátrium ezüstös fehér fém sp. súlya 0,97, olvadáspontja 97,7 ° C. Nátrium olyan puha, könnyű vágni egy késsel. Mivel a fény-oxidok lyaemosti levegő rendszerint nátrium alatt tárolt paraffin réteg.
Metal nátrium van egy meglehetősen széles körben használják. Ez szolgál kiindulási anyagként a termelés nátrium-peroxid és a nátrium-amid, és használják sok szintézisnél a szerves vegyületek. A laboratóriumokban nátrium gyakran használják, hogy távolítsa el az utolsó nyomait nedvesség bizonyos szerves oldószerekben.
Mivel a higany nátrium-formái egy szilárd ötvözetet - nátrium-amalgám, amely néha használják a redukálószer helyett tiszta fém.
Mivel a nátrium-oxigén képez két vegyületet: a nátrium-oxid-Na2 O Na2 O2, és nátrium-peroxid.
Nátrium-oxid Na2 O állíthatjuk elő áthaladó nátrium fűtött nem magasabb, mint 180 °, mérsékelt mennyiségű oxigént, vagy nátrium-peroxidot melegítéssel fémnátriummal:
nátrium-oxid hevesen reagál a vízzel és a képződő nátrium-hidroxid, és izoláljuk a nagy mennyiségű hő:
Na2 O2 nátrium-peroxidot elégetésével keletkezett nátrium-levegő vagy oxigén. A gyári körülmények között, nátrium-peroxidot úgy állítjuk elő, nátrium-fém lapos alumínium serpenyők, helyezzük vas cső, amelyen keresztül a levegő áram halad megszabadítjuk a szén-dioxid. Az így kapott termék a sárgás por alakjában, és körülbelül 93% Na2 O2.
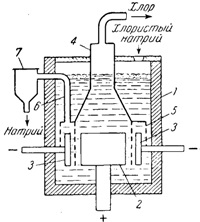
Ábra. 141. előállító berendezés, fém-nátrium nátrium-klorid: 1 - vas burkolat; 2 - az anód; 3 - a katód; 4 - Bell; 5 - mesh partíció; 6- csövet; 7 - egy gyűjtemény
Nátrium-peroxid egy nagyon erős oxidáló tulajdonságait. Sok szerves anyagok vele kapcsolatba meggyullad.
Enyhe nátrium-peroxidot hideg vízben feloldjuk, tartalmazó, kapott oldatot a nátrium-hidroxid és hidrogén-peroxid. Emlékezzünk, hogy az összes peroxidot tekinthető jelenleg, mint a só egy nagyon gyenge sav - hidrogén-peroxid. Ezért, a kölcsönhatás a nátrium-peroxid lényegében vízben jelentése hidrolizáljuk képezett sót egy gyenge sav és egy erős bázis:
Ha a kapott oldatot melegítjük, azután a hidrogén-peroxid bomlását, oxigén- azokból.
Amikor oldást nátrium-peroxid savat úgy is előállíthatjuk, a hidrogén-peroxid.
Mivel a formáció a hidrogén-peroxid való oldódás Na2 O2 vízben vagy híg savakban, nátrium-peroxidot széles körben használják a textília fehérítésére, gyapjú, selyem, szalma, tollakkal és m. P.
Fontos közötti reakció-peroxid szén-dioxiddá Tria:
O február 2 - + 2e - = 2O -
Ebben a reakcióban a nátrium-peroxidot, a szigetelő maszkok, valamint tengeralattjárók abszorpciós kilélegzett szén-dioxid az emberek és egyidejű feltöltésére savanyú jellegű levegőben.
NaOH nátrium-oxid-hidrát szilárd, fehér, nagyon higroszkópos anyag, amelynek olvadáspontja 328 ° C. Mivel az erős korrozív hatása szövet, bőr, papír és egyéb szerves anyagok is nevezik marónátron ( „szóda” régi neve nátrium-oxid).
A víz oldja a nátrium-hidroxid a kiadás nagy mennyiségű hő miatt kialakulását a különböző hidrátokat.
Marónátron kell tárolni jól lezárt konténerekben, mivel könnyen elnyeli a szén-dioxidot a levegőbe, fokozatosan fordult a nátrium-karbonát.
Az alapvető eljárás előállítására NaOH elektrolízise vizes nátrium-klorid-oldattal. Amikor egy áramot vezetünk a katód kisülés
hidrogén ionok és egyidejű felhalmozódása hidroxil ionok így egy nátrium-hidroxid; klórt az anód felszabadul. Fontos, hogy az elektrolízis termékét nem lehet vegyes mivel egyébként a nátrium-hidroxid reagál klórral képeznek NaCl és NaCIO:
2NaOH + Cl 2 = nátrium-klorid + NaCIO + H2 O
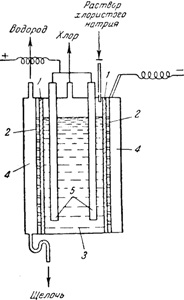
Ábra, 142. reakcióvázlat elektrolitikus fürdő egy függőleges apertúrát;
1 - rekeszizom; 2 - a katód; 3 - anódrekeszt; 4 - katód-terület; 5- anódok
Számos módszer, hogy megakadályozzák a behatolást a klórt nátrium-hidroxid-oldatban. A leggyakrabban használt diafragmennyysposob, ahol az anód és a katód terek vannak elválasztva partíció készült azbeszt. Az elektrolitikus fürdők, amelyek arra szolgálnak, hogy megkapjuk a nátrium-hidroxid a ez a módszer (ábra. 142), függőlegesen szerelt 1 membrán fekvő, közel a perforált vas katód 2, 3 elválasztja az anódtérben a katód 4. az anódok grafitrudak 5. A folyamat az elektrolízis az anód térben folyamatosan szállított nátrium-klorid-oldattal, és áramlik a katód keverékét tartalmazó oldatot NaCl
és NaOH. Annak párolgás és kristályos nátrium-klorid, csaknem tiszta alkáli-oldatban. Utolsó kondenzált NaCl és bepároljuk teljesen eltávolítani az összes vizet. A kapott alkálifém-megolvadt és formákba öntjük. A melléktermékek a készítmény nátrium-hidroxid a klór és a hidrogén.
Számos különböző áramlik elektrolízis NaCl-oldattal, ha a katód a fémes higany. Ebben az esetben, nem mentesül a katód, hidrogén-ionok és nátrium-ionok. A felszabadult nátriumot feloldjuk higanyt, alkotó olvadt ötvözet, az úgynevezett nátrium-amalgám. Melegvíz könnyen degradálja az amalgám, ahol a kapott marónátron, hidrogén szabadul fel, és a felszabadult higany. Így, higanyos katódként, akkor lehetséges teljesen tiszta nátrium-hidroxid nem tartalmazó szennyezőt mennyiségű el nem bomlott nátrium-klorid.
Ábra. 143 folyamatábráját mutatja rendszer előállítására marónátron a higany módszerrel. A telepítés két részből áll - a cella 1, ahol nátrium-amalgám képződés bekövetkezik,
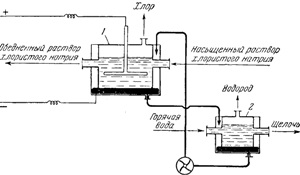
Ábra. 143. Circuit megszerzésének nátrium-hidroxid-Hg-módszerrel
Emellett az elektrolitikus folyamat előállítására nátrium-hidroxid. Néha még ma is használják a régebbi módszer - forrásban lévő szódás oldatban hidratált mész:
A reakció után az oldatot dekantáljuk a kalcium-karbonát csapadék és víz elpárologjon, a kapott fuzionált marónátron.
Marónátronoldat egyik legfontosabb alapvető termékek a vegyipar. Éves világ (kivéve a Szovjetunió) fejleszteni azt meghaladja a 6,5 millió. Tonna. Szoba eladni érkezik nevezett nátronlúg. Hatalmas mennyiségű nátrium-hidroxid fogyasztott olajipar, ahol NaOH-ot használunk tisztítására kőolajtermékek, a szappan ipar, papír, textil, szintetikus szálak előállítása, és számos más iparágakban.
Termelés nátrium-hidroxid a Szovjetunióban 1955 összesen 563.400. G, több mint 10-szer magasabb, mint a termelés nátronlúg a forradalom előtti Magyarországon. A 1959-1965 ,. Előállítása nátronlúg a tervek szerint növekedni többször képest 1955
nátriumsó. A nátriumsó formák minden ismert savak. Mivel a legfontosabb nátrium- és alkalmazásaik leírták a megfelelő savakkal, itt csak felidézni őket.
Minden festett nátrium lángja sárga. Ez a reakció lehetővé teszi, hogy jelenlétének kimutatására a legtöbb jelentéktelen mennyiségű nátriumot a vizsgált anyagot.