Mg2 összetett és ATP
A legtöbb enzim katalitikus elvégzésére szükséges funkciók koenzimek. Kivétel sostavlyayutgidroliticheskie enzimek (proteáz, ribonukleáz, lipázok) a készítményben nincs aktív centrumában koenzimek.
Koenzimek vannak beágyazva az enzim aktív helyéhez, és közvetlenül részt vesznek a katalitikus folyamatot. Ha kovalens kötés - egy koenzim nevű prosztetikus csoport (lipoát, biotin, FAD, FMN). Koenzimek gyakran vitaminok és származékaik.
Apoenzim meghatározza szubsztrát specifitását transzformációk. Ugyanez koenzim épített különböző apofermentami is részt vehetnek a különböző átalakításokat az aljzat. Például, piridoxál-foszfát (koenzim formában B6-vitamin) is részt vesz a reakciók transzaminálás és dekarboxilezése - minden attól függ, a apoenzim együtt, amelyhez társítva van. Koenzimek:
drágaköveket (prosztetikus csoport). Része a citokróm, NO-szintáz, kataláz, peroxidáz, guanilát-cikláz, citokrómok.
Mint sok fehérjék, enzimek lehetnek monomerek. azaz Ez áll egy alegység ipolimerami. amely több alegységből áll.
Egyes enzimek, például a piruvát-dehidrogenáz multienzim komplex, kötő glikolízis és a trikarbonsav ciklusban, megköveteli öt koenzimek és szerves egy fémion: tiamin-pirofoszfát (THP) kovalensen svyazannyylipoamid és flavin-adenin-dinukleotid (FAD) ko-szubsztrát -nikotinamid-adenin-dinukleotid (NAD), a koenzim-A (CoA) és a magnézium-ion (Mg2 +).
Aktív és alloszterikus enzim központok.
Részeként az enzim elszigetelt terület elvégzésére különféle funkciókat:
1. Az aktív centrum - kombinációja aminosavak (általában 12-16), amely közvetlen kötődését a szubsztrát molekula és végre katalízis. Az aminosav gyökök az aktív centrum lehet bármely kombinációban jelen, a következő aminosav lehet található jelentősen távol egymástól egy egyenes lánc.
Enzimek, amelynek az összetételében több monomer lehet több aktív centrumok számától alegységek. Továbbá, két vagy több alegység képezhetnek egyetlen aktív centrumában.
A komplex enzim aktív helyén szükségszerűen elhelyezett funkcionális csoportok a kofaktor.
Másfelől, az aktív oldalon két okból:
Anchor (pin összekapcsolása) - kötéséért felelős és orientációja a szubsztrát az aktív központban,
katalizátor - közvetlenül felelős a végrehajtásához a reakció.
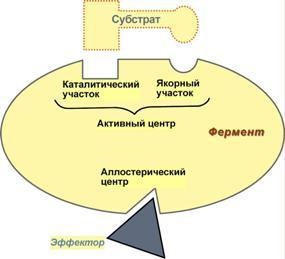
diagramja a szerkezet enzimek
2. alloszterikus központ (allos - ellenfél) - a központ a szabályozása az enzimaktivitás, amely térbelileg elkülönül az aktív hely, és nem az összes enzim. Kötődés alloszterikus közepén egy molekula (úgynevezett egy aktivátor vagy inhibitor, és az effektor modulátor vezérlő) megváltoztatja a térbeli konfigurációját az enzim fehérje (aktív hely), és ennek következtében, az arány a enzimatikus reakció. Mivel egy ilyen szabályozó lehet egy termék az ilyen, vagy egy következő reakcióhoz, a reakciót szubsztrát vagy más anyag.
Alloszterikus enzimek a legtöbb esetben a fehérje negyedleges szerkezet, az aktív és a szabályozási központok létezhetnek különböző alegységek.