Kétértékű fémionok - hivatkozási vegyész 21
Kémia és Vegyészmérnöki
A kétértékű fémion elektrokémiai mentesítési eljárás amalgám fém olyan oldatból, amelynek aktivitása az L-5-10- mol hőmérsékleten 293,2 K függőségi létezik [c.115]
Lépésenkénti ionizáló mechanizmust jelentősen befolyásolja az alak a polarizációs görbéket ua. ahol ennek eredményeként ez nem egy, hanem több Tafel ábrázolja különböző pályákon. Tekintsük egyenlet és az annak megfelelő polarizációs görbe vonatkozásában a legegyszerűbb esetben két lépésben ionizációs folyamat, aminek következtében végül is a kialakulását kétértékű fémionok a egyenlet megoldása (8.11). Legyen a és P - az átviteli koefficiensek, h egyértékű fémion a konverziót és a fordított átalakítás. a „és P” - ugyanazokat az együtthatókat az átmenet két vegyértékű ion és egy kétértékű, és fordított folyamat. [C.199]
Megjegyezzük, hogy a kristály területén stabilizációs (nulla ligandok) - ez csak az egyik tényező a stabilitás biztosítása a átmenetifémek. Ábra. A 23. ábrán a kísérleti adatokat a melegíti a hidratációs víz komplexek két- és háromértékű ionok az első hosszú ideig [164, 166, 170]. Pontok (keresztek) elrendezett pas görbe két maximumok és minimumok a Mn + és a Fe +. Ha kivonás energiája stabilizáció a kristály mező. korrigált érték (zárt pontok) helyezkedik el a sima görbe. emelkedik a az időszak végén. Ez a fő hozzájárulása a komplex stabilitása határozza meg a vonzereje a ligandumok a lényege gömbszimmetrikus fémion. Ez növeli a csökkenése a felelős és ion sugara. Az, hogy a komplexek stabilitását két vegyértékű fémion az első hosszú ideig majdnem minden ligandumok [164] növekszik száma Mn> Zn +. [C.52]
Sokkal több adat áll rendelkezésre az összehasonlításhoz donoratom, például nitrogén-, oxigén- és kénatom. Schwarzenbach és munkatársai [274] meghatározott stabilitási állandóval a komplexek nagy számú kétértékű fémionok többfogú ligandumok I. típusú (Y = NMe, O vagy S) [c.57]
Bizonyos esetekben a kelátképző javítja az elválasztás. Így, hogy kicsapjuk a hidroxidok vas, alumínium, króm és hasonlók. D. Széles körben használt ammónia, mint a lehetőségét ko-precipitációja kétértékű fémionok, mint például réz, nikkel, kobalt, cink, és így tovább. G. minimalizálható, mivel képesek alkotnak ammónia komplexek . [C.303]
Fele elemeit az M + / M és M + / M-Hg tanulmányozására használtuk komplexek egyes fémionok, amelyek a táblázatban mutatjuk be. 7-1 sok más példa az a fém és az amalgám elektródák vannak megadva [38, 39]. A legtöbb esetben, az M fém egy eleme az átmeneti csoport a periódusos rendszer. Az amalgám fő csoport fémek az 1. és 2. csoportok bomlik vízben, és nem használják széles körben a tanulmány az egyensúlyt. Mindazonáltal áramlási amalgám elektródákat lehet használni vizes oldatok [114]. Joseph [120] tanulmányozták a kölcsönhatás a fehérjék kalcium segítségével amalgám elektród. védve az oldatot egy műanyag zacskóba. Viselkedés fém amalgám elektródok, és engedelmeskedik az egyenlet (7-3) akár a fém-ion koncentráció 10 -10 M, de a használata ennek az egyenletnek a hígabb oldatok vezet hibákat. A felső határ a koncentráció, amelyre a megfigyelt egyenletet (7-3) úgy határozzuk meg, az a tény, hogy lehetetlen fenntartani az állandó aktivitását együtthatóit a nagy változások az ionerősség. Így, az egyenlet (7-3) alkalmazható oldatok ionok (LM), Na + (M 3 -2) és SYU4 (ZM) csak a régióban 6 0,01 M és kétértékű fémionok, valamint egy régió 6 Zn. Ezt a szekvenciát a törött koordinációs szám nagyobb, mint négy, - részben annak a ténynek köszönhető, hogy a réz és a cink-ionok képzésére hajlamosak csak négy koordinációs kötést ligandumok, kivéve a víz. Általában C> Y1> 2n, de komplexek rendelkező ligandumok szulfit-csoport gidrilnuyu, 2n aktívabb, és formáját ölti sorozata C> 2n> M1. [C.403]
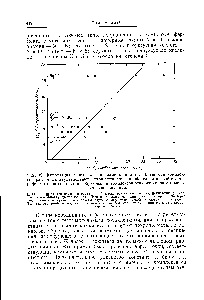
Ábra. 79. Korreláció a logaritmusai stabilitási állandóit komplexek különböző kétértékű fémionok karboxipeptidáz és a logaritmusai első állandók komplexképzési az ionok a modellel vegyületek.
Az ioncserélő kapacitású ioncserélők típusától függ a számláló. Például, karboxilcsoportot kation könnyebb kétértékű fémionok szorbeálódnak, mint egyértékű. Ez a specifikusság meghatározása termodinamikai szelektivitás és cserélő kapacitása. Annak megállapítására, a pH hatását a csere kapacitás a kétértékű fémionok a használata kényelmes, [144] Az arány [c.67]
Mennyiségileg kevéssé ismert régióban marad többértékű ionokkal szorpciós szerves anyagok. Ismeretes, hogy a szorpciós a kétértékű fémionok cserébe monovalens gyakran kíséri növekedése entrópia [206]. Azt feltételezték, hogy a két mikroállapot merül fel két vegyértékű ionok, szemben az egyik a pár vegyértékű mikroállapot. Modell ábrázolások ilyen szorpciós bevezetése válik szükségessé számos fenntartást. Először is, meg kell rezinátok monovalens ionok azonos. Ioncserélő kerül sor a egyenértékűségét a törvényeket. A kétértékű ion a ioncserélőt kell jellemezve, hogy legalább két, az energia mikroállamok, ami lehet, mint a lehetséges állapotait egy nagy energia miatt egy fix és alacsony ion miatt a többi összhangban restrikciós a mobilitás a ioncserélő hálós szerkezet. [C.116]
ón ionok (P) és ón (1U) viselkednek egy adott módon monofunkciós imino gyanta. Bár a viselkedés szobahőmérsékleten Sn ionok normális viselkedése kétértékű fémionok, a eltávolítása nyomait ón monofunkciós iminodiecetsav gyanták (és más Hélonnak gyanták) szinte lehetetlen, mivel a gyanta mindig marad nyomokban hidrolízis termékek. A legjobb ezek a nyomok eluálhatók alacsony hőmérsékleten, savak, komplexképző szerek vagy poliszulfid oldattal. Magas hőmérsékleten. Azonban, a kivált ón-oxid-hidrát dehidratált, úgy, hogy minden eltávolítása tarthatatlan. Ha valaki nem akar zárja jelenlétében ón só, vagy egy nyom, ezeket a tényeket kell figyelembe venni. [C.136]
Normális eloszlás. amikor az összes kétértékű fémionok pozíciók A-M + [Ms +] X4. [C.5]
Egyszeres töltésű fémion M + van megválasztva, hogy egyszerűsítse a egyenletek. és ez a választás nem jelenti azt, hogy az ilyen ionok extraháljuk könnyebben. Mivel a tárgyalt okokból a következő cikkben, néhány komplexei háromértékű és kétértékű fémionok extraháljuk könnyebben. [C.258]
A táblázat magában foglalja a konstansok hidratált elektron rögzítési ráta kétértékű fémionok. Amikor használják elektron befogadására befogó megjelenéséhez vezet monovalens ionok. gyakran instabilak az oldatban, vagy az elektród felületén. Például, az oldatok RR +, C (1 + és Cu + photocurrents elenyészően kicsi az összes rendelkezésre álló mérési tartományban potenciálok (a küszöb-potenciál a potenciális sötét csökkentése kétértékű fémionok a higany.) Nyilvánvaló, egyértékű ionok ezen fémek gyorsan oxidálódik, az elektróda. de, bár, például, és a C (1 + nem ad saját fotoelektromos, ez nem zavarja a mérést, és a befogó sebességi állandóit a hidratált elektron akceptor versengő egy fent leírt módszer. Ezzel szemben, látható fényáram megfigyelhető a p astvorah N1 + és Mn +, mint amely jelzi a lassú oxidáció N1 + és Mn + egy higany elektród a potenciális vizsgált tartományban [25]. [c.134]
Lépésenkénti ionizáló mechanizmust lényegében skazyvaetsy alkotnak polarizációs görbéket. ahol ennek eredményeként ez nem egy, hanem több Tafel-nek részre különböző pályákon. Úgy véljük, az egyenletet és a megfelelő polarizációs, a görbe vonatkozásában a legegyszerűbb esetben két lépésben ionizációs folyamat, aminek következtében végül is a kialakulását kétértékű fémionok a egyenlet megoldása [c.113]
Hidroxi-kinolin (oxin) használják tömeg meghatározására sok fémet. Előállítása komplexek szigorúan meghatározott összetételű Mg (a koordinációs száma a fémion, n = 4), az Mz (amikor n = 6), és az ML4 (amikor n = 8), szárítás után lehetővé teszi, hogy használja a megfelelő oxinát mint ü formák. A kétértékű fémionok, hogy oldhatatlan komplexeket képeznek a típusú, amelyre Mg és esetleg súlymeghatározása ezzel a módszerrel, lehetőség van, hogy meghatározza a Mn2 + Co +, N +, Cu2 +, CC12 +, Pb + ionok, stb-A1 +, Pd +, B1 + oldhatatlan komplexeket képeznek MLZ típusa és Th + típusától és ML4. Felvétele nagyobb számú ligandumok a komplexek oksynatnye nagyban csökkenti a konverziós tényező a megfelelő fém-oxinát használ, mint egy súlyozott formában. Például, a 2m komplex [Ox] 4 [c.222]
Összesen hidratációs hő AGN más fémionok (M) jól ismertek [131, 242] és a tartomány a -100 és -1500 kcal / mol. Williams [309] azt mutatta, hogy 18 értékeket a kétértékű fémionok segítségével vihető át az empirikus egyenlet [c.37]
A komplexek az alacsony-spin tetraéderes komplexeket és érvelés némileg eltérő, de a jósolt DYagaz szekvenciát ezekben az esetekben ez jellemzi nalichtsem csomópont konfigurációt, ha egy fémion d, [114]. Értékek AYagaz hexes -mini kialakításához kétértékű fémionok az első átmenetifém alkalmazásával számítottuk ki a ciklus Haber - Born [68, 115] és összhangban vannak a megjósolt szekvenciáját Ugyanez vonatkozik azokra az értékekre D hidr (M) az ilyen fémionok [131] (ábra . 3). Kivonása orbitális stabilizáció (amely lehet kiszámítani az abszorpciós spektrumok a látható tartományban), a teljes entalpiáját megváltozik poluchayut- [c.38]
A logaritmusai stabilitási állandóit komplexek azonos ligandummal lantanidák és átmeneti fémek először a kifejezett függését a atomszáma a központi fémion. Ennek köszönhetően kompressziós iantanoid sorozat ilyen függőség egyenértékű funkciója 1 / Hz (lásd. V. szakasz, 1). Sok a rendelkezésre álló adatok 1952 F. A komplexek két vegyértékű fémion, az első átmeneti időszak felülvizsgálták Irving és Williams [142]. Értékek lgiG vagy 1DR (n 2n. Az eljárás ugyanaz volt megfigyelhető. Mint azt később, és számos ligandumok donor kénatomot [144, 180a, 283]. A közelmúltban definiált stabilitási acetát [315], a-alanin [115, 313 ] és etilén-diamin [2251 komplexek Cr (II), és megállapította, a sorrendben a Cr> Mn (ábra. 8). Továbbá, nincs erős tetragonális mezők vagy k> 4 fordított sorrendben talált N1> C [32, 313]. [c.51 ]
Kétértékű fémionok, beleértve kobaltot ionokat, elválasztjuk a vas (P1) a ICF rendszer - HC1 utolsó eluáltuk 0,5 M H I [66]. Ugyanez a rendszer szétválasztására Co (II) és Fe (a) használt Preobrazhenskii et al. [81]. Eljárást ismertetnek, vas- (III) a különböző elemek a rendszer 2-oktanon - HC1 [41]. Mikulski et al. [67] azonosítottak több [c.247]
Ionos kristály speciális elektromos tulajdonságait nem csak a munka, hanem a szennyező anyagok, különösen töltött helyettesítő szennyeződéseket. Ezek szerepe van kétértékű fémionok gyakran helyettesíthető kationok ilyen rácspont hiba. természetesen szintén rendelkezik redundáns Coulomb energia. hanem azért, mert ez előnyös, hogy összeáll egy negatív töltésű kation megüresedett. Nem nehéz megérteni, hogy az elektromos tulajdonságai pár szennyező üresedés, alig különbözik divacancies fent tárgyalt. Azonban a helyi alakváltozás a kristály, valamint a lehetséges dipólus orientációban a kristályrács eltérő divacancies. Az utóbbi legyen legalább az a tény, hogy mind a hiba (egy feltöltött szennyező, és a megüresedett) találhatók ugyanolyan ion-sublattice. [C.181]
Ferrocén - csak az egyik egy nagy számú átmenetifém-vegyületek. amelyek magukban ciklopentadienil ani-on. A fémek közül a. képző zhtaldotseny, vagy szendvics típusú szerkezete hasonló rrotsenu nikkel, titán, kobalt, ruténium és ozmium. Stabilitás metallocének függ a fém és annak oxidációs állapotát a legstabilabb ferrocén, ruthenocene osmocene és így, az ezeket a vegyületeket, a kétértékű fémion szerez egy elektronikus konfiguráció inert gáz. [C.232]
A kovaföld válik hidrofób képződését oldhatatlan fémes szappan és szilícium-dioxid felületén [57]. Például, kezeit szilícium-dioxid kalcium-hidroxid vagy bárium-hidroxid vagy bázikus magnézium-karbonát, hogy így oldhatatlan szilikát bevonattal. ami viszont kezeljük szappannal. A kétértékű fémion kötődik. Nyilvánvalóan zsírsav kre.mnezema felületre. Króm-klorid-sztearát irreverzibilisen adszorbeálódik th e alkotnak egy egyrétegű a kovasav felületén, így erősen hidrofób. [58] Ebben PO- [c.242]
Mivel az a képesség, hogy egy kellően erős kötések a fehérjék és más polimerekkel. így például a cellulóz, pektin, tannin a fő különbség a többi fenolos vegyületek. érdeklődés röviden rasslyutret ezeket a kapcsolatokat. A tanninok képesek képezni három típusú kommunikáció, első, lehetséges hidrogénkötések között fenolos hidroxil-csoportok tannin és szabad amino-csoportokat és amidcsoportokat a fehérje. hidroxil- vagy karboxilcsoportjai és más polimerek másrészt lehetséges ionos kötések közötti megfelelő töltésű anionos csoportokat tannin és kationos csoportokat a fehérje vagy, abban az esetben, más makromolekulák. obrazovapie esetleg kevert sók a megfelelő két vegyértékű fémion, például kalcium Végül harmadszor, lehetséges a kovalens kötés. úgy állítjuk elő, kino -New vagy szemikinon csoportok, amelyek jelen lehetnek a tanninok, a megfelelő reaktsiopnosposobnoy csoportot fehérjemolekula, vagy más polimert. Odpako első két típusú kommunikációs, természetesen könnyen szakadt stabilitását bármely képződött komplex révén az ilyen kapcsolat, ez nem csak attól függ a koncentráció a tannin és otnosite.yanyh polimert a reakcióban résztvevő, és az oldat pH-ionerősség. valamint a jelenléte reagensek. elpusztítja a hidrogénkötéseket. vagy egy fém kialakítására képes kelátok. Másrészt, a képességét, tanninok, hogy tartós kovalens [c.330]
It From [etit, hogy kétértékű fém-ionok különböző tendencia, hogy komplexeket képeznek típusú 1 2 [c.98]
Ha keveréket használunk a kétértékű fémionok adszorbeáljuk monofunkciós iminodiecetsav gyantát. majd az oszlopot híg ásványi savak. egyes ionok poyavlya- [c.112]