galvánelemek
Elektrokémiai cellák a egyenfeszültség-forrásra, és az úgynevezett elsődleges elemeit. A villamos energia ebben az esetben kapott van kialakítva eredményeként fellépő kémiai reakciókkal a sejten belül. Tekintsük azt az elvet egy egyszerű sejt.
Elem (. 48. ábra) áll egy hajó, amelynek kénsav-oldattal (H2 SO4), amelyben két eltérő lemezeket szállított: cink és a réz. A tapasztalatok azt mutatják, hogy a cink ebben az esetben felszámított
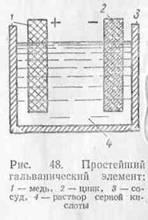
negatívan, és a réz - pozitív. Az elem két O - pólusú: pozitív (anód) és negatív (katód).
Cink lemez, süllyesztjük kénsavas oldat feloldjuk benne. Az a képesség, hogy könnyen adja a cink-elektronokat vezet az a tény, hogy a cink-atom. hagyva a két lemez elektron. Ez megy oldatba pozitív ion. Között a lemezt, és a cink-oldatot van némi potenciál különbség, amely felfüggeszti a további cink oldódását az lemezek.
Hagyja a rézlemezek oldatot. A kisebb képessége oldódása réz képest az oldat lesz más potenciális különbség, mint a cink. Így, a réz és a cink lemezek képződött potenciális különbség.
A potenciálkülönbséget (pl. Q. S.) A lemezek között (elektródák) réz-cink elem megegyezik 1.1.
Amikor a záróelem pólus elektronok cink fémes vezető lemez fog mozogni, hogy a rézlemez. Mivel a potenciális veszteséget az elektronok közötti a lemez és a cink-oldatot csökken, és egy új részét cinkionok át az oldatba a lemezről, a lemez maga dúsított ismét elektronokat. Pozitív cinkionokat, egyszer oldatban, csatlakozik a negatív ionok-maradék SO4 - és a forma cink-szulfát-molekula
Pozitív hidrogénion H2 ++. megy a rézlemez,
tart a szabad elektronok és semlegesítik, ami buborékok formájában felszabadul, amely a rézlemez. Ennek eredményeként ez az eljárás a cink-lapot, hogy savban oldjuk, feltölti elektronok, és egy vörösréz lemez, amely az elektronok fenntartja pozitív töltés, és fedi buborékok hidrogén. mozgását elektronok fordul elő a külső áramkörben a cinklemezből a réz, az elektrolit belül a negatív ionok mozognak a réz, a cink, és a pozitív ionok - a cink réz. Árammérő az áramkörben működési réz-cink elem gyorsan csökken. Ez azért van, mert a réz lemez, hidrogénnel együtt, amely magában foglalja ezt a lemezt képez egyfajta galvanikus pár, egyfajta szinguláris elem, pl. d. a. amely ellen irányul
e. d. a. magát az elemet. Ezt a jelenséget nevezzük polarizáció. Mivel az erős polarizáció a réz-cink elem nem talált gyakorlati alkalmazása.
A nem-polarizálható elemek közé tartozik a cink-szén sejt. Az elektródok szolgálnak neki a szén és a cink-lemezek, elektrolit - ammónium-klorid-oldatot (NH + C1). A szén-rudat leeresztjük a zsákot peroxidot mangán (MnO2), mely kiküszöböli a polarizáció és a hívott depolarizátor. E. g. A. 1,45 db áron. Működés közben a cink-szén sejt felszabaduló hidrogén oldatból, hogy peroxiddal reagáltatjuk mangán:
így a víz, és a polarizációs eleme zajlik.
A legtöbb cink-szén elemek készülnek formájában úgynevezett száraz sejt.
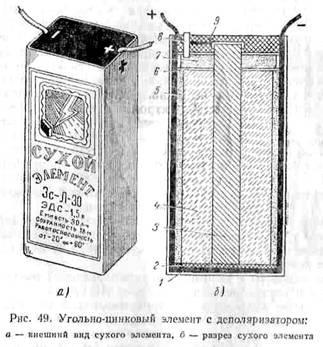
Ábra. 49 ábra egy mangán száraz sejt depolarizációját. Cink elem kerül egy doboz 2, ami szintén negatív pólusa az elem. Top box beillesztett karton felett. A közepén a doboz a szén-dioxid 3 rúd, amely a pozitív pólusa az elem. körül
szén-rúd 4 depolarizátor áll zúzott szemek mangán-peroxid, grafit és korom, áztatott ammónia oldatban. Depolarizátor zsákba készült muszlin. Izolálására depolarizátor cink cink az alsó kartondobozban 1 betétet tegye.
Kívül zsákot depolarizátor 5 körül egy paszta álló olcsó lisztek oldattal impregnáljuk ammónium-klorid. Hogy megakadályozzák a pasztát szárítás a pusztulás és a receptúrája cink-klorid. Top tasak depolarizátor kartonból fedél 6 tömítés, tetejére öntjük, amely egy réteg fűrészpor 7, is borított egy karton bélés.
Cink dobozok és szén rúd készült két off. Az a gázoknak az eltávolítása során termelt a cella működése, a tetején egy üvegcső 8. A felső elem 9 része van töltve gyantával.
Száraz elemek mangán depolarizáció e. d. a. 1,4-1,6 belső ellenállása 0,1-0,5 ohm.
A legnagyobb mennyiségű villamos amperórák, amelyek tehetik az elem a folyamatban, az úgynevezett kapacitív elem.
Elektrokémiai cellát használt a hatalom az akkumulátor rádiók, néhány fizikai és elektromos készülékek, hordozható világítás, jelzés.
Galvanikus sejtek és más kémiai energiaforrások hagyományosan jelöltük a diagramok, ábrán látható módon. 50.