Formula kloridok Chemistry
Meghatározása és kloridok képletű
Sósav egy egybázisú sav, amely megy a disszociáció szerinti vizes oldat a következő egyenlet:
HCI ↔ H + + Cl -.
ezáltal egy sót - klorid (NaCl - nátrium-klorid, CaCl2 - kalcium-klorid, AICI 3 -kloridokat alumínium, stb).
Attól függően, hogy milyen típusú kémiai kötések közötti tartalmaznak a molekulában, megkülönböztetni ionos kloridok, amelyek kristályos szilárd anyagok magas olvadáspontú; kovalens kloridok képviselő mind gáz-halmazállapotú anyagok és folyékony vagy alacsony olvadáspontú szilárd anyagok. Egy jelentős része a klorid jól oldódnak vízben.
Kémiai képletek kloridot
Kémiai képletek kloridok úgy a példában nátrium-klorid - nátrium-klorid, CaCl2 - kalcium-kloridot és AICI3 -kloridokat alumínium. Kémiai képlet mutatja a minőségi és mennyiségi összetétele a molekula (száma és típusa atomok tartalmazza a specifikus vegyület) szerint kémiai képlet számított molekulatömege kloridok (Ar (Na) = 23a.e.m. Ar (Cl) = 35,5 AU m. Ar (Ca) = 40 amu Ar (Al) = 27a.e.m.):
Mr (NaCl) = Ar (Na) + Ar (Cl);
Mr (NaCl) = 35,5 + 23 = 58,5.
Mr (CaCl2) = Ar (Ca) + 2 × Ar (Cl);
Mr (CaCl2) = 40 + 2 × 35,5 = 40 + 71 = 111.
Mr (AICI3) = Ar (Al) + 3 × Ar (Cl);
Mr (AICI3) = 27 + 3 × 35,5 = 27 + 106,5 = 133,5.
Strukturális (grafikus) kloridok képletű
Structure (grafika), a képlet intuitív. A szerkezeti képlet például foszfátok azonos NaCl - nátrium-klorid, CaCl2 - kalcium-kloridot és AICI3 -kloridokat alumínium.
Ábra. 1. Szerkezeti képlet a nátrium-klorid.
Ábra. 2. Szerkezeti képlet a kalcium-klorid.
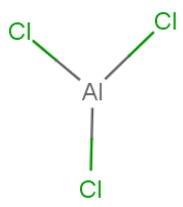
Ábra. 3. A szerkezeti képlete alumínium-klorid.
ionos képletű
Kloridokat átlagos sók, amelyek képesek disszociáló ionokra vizes oldatban:
NaCl ↔ Na + + Cl -;
CaCl2 ↔ Ca 2+ + 2Cl -;
AICI3 ↔ Al 3+ + 3CI -.
Példák problémák megoldása
Amikor teljes égésű oxigént tartalmazó szerves anyagot tömegű 13,8 g kapott 26,4 g szén-dioxidot és 16,2 g víz. Find molekuláris képlete az anyag, ha a relatív sűrűsége gőzének hidrogén 23.
Felvázolt égési reakciója szerves vegyületek, amelyek megadott számú szénatomot tartalmazó, hidrogén és oxigén az «X», «y» és «Z», rendre:
Tömegének meghatározásához az elemek alkotják az anyag. Az értékek a relatív atomi tömegeket venni a periódusos D. Mengyelejev, egész számra kerekítve: Ar (C) = 12 amu Ar (H) = 1 amu Ar (O) = 16 amu
Kiszámítjuk a moláris tömege a szén-dioxid és víz. Mint ismeretes, a moláris tömege a molekula az összege a relatív atomi tömegek a tartalmaznak a molekulában (M = úr):
M (CO2) = Ar (C) + 2 × Ar (O) = 12+ 2 × 16 = 12 + 32 = 44 g / mol;
M (H2O) = 2 × Ar (H) + Ar (O) = 2 × 1 + 16 = 2 + 16 = 18 g / mol.
m (C) = [26,4 / 44] × 12 = 7,2 g;
m (H) = 2 × 16,2 / 18 × 1 = 1,8 g
m (O) = m (Cx Hy Oz) - m (C) - m (H) = 13,8 - 7,2 - 1,8 = 4,8 g
Definiáljuk a kémiai képlet szerinti vegyület:
x: y: z = m (C) / Ar (C). m (H) / Ar (H). m (O) / Ar (O);
x: y: z = 7,2 / 12 1,8 / 1: 4,8 / 16;
x: y: z = 0,6. 1.8. 0,3 = 2: 1 6.
Ezért a legegyszerűbb általános képletű vegyületet a C2 H6 O moláris tömege 46 g / mol [M (C2 H6 O) = 2 × Ar (C) + 6 × Ar (H) + Ar (O) = 2 × 12 + 6 × 1 + 16 = 24 + 6 + 16 = 46 / mol].
Moláris tömeg szerves anyag lehet meghatározni a sűrűsége a hidrogén:
Msubstance = 2 × 23 = 46 g / mol.
Ahhoz, hogy megtalálja a valódi képletű megtalálják az arány a szerves vegyület kapott móltömeg:
Ez azt jelenti, egy szerves vegyület, a képlet formájában fog a C2 H6 O.