fizikai tulajdonságok
StirolC8H8 (feniletilén, vinil-benzolból, etil-benzol) - színtelen folyadék, jellegzetes szagú. Gyakorlatilag nem oldódik vízben, szerves oldószerekben oldható, egy jó oldószert polimerek.
A legtöbb sztirol (körülbelül 85%) állítunk elő az iparban degidrirovaniemetilbenzola hőmérsékleten 600-650 ° C, atmoszferikus nyomáson, majd túlhevített gőzzel 3 - 10-szer. Használt vas-króm-oxid katalizátorokat a kálium-karbonát adagolásával.
Egy másik ipari folyamat, amely megkapja a fennmaradó 15% az degidratatsiimetilfenilkarbinola. az eljárás során kialakult a propilén-oxid az etilbenzol-hidroperoxid. Etilbenzol hidroperoxid oxidációjával kapott etil-benzol nem katalizált levegő.
Fejlettebb alternatív előállítási eljárásai sztirol. Katalitikus cyclodimerization butadién vinil-ciklohexén, majd dehidrogénezéssel vele. Toluol oxidatív kapcsolási alkotnak sztilbén; metatézis sztilbén etilénnel vezet sztirol. Toluol reagáltatásával metanollal is előállíthatók a sztirol. Ezen túlmenően, aktívan fejlesztett módszerek izolálására sztirol pirolízis folyékony termékek. A mai napig ezen folyamatok egyike gazdaságilag nem életképes, és nem hajtják végre az ipari méretekben.
A sztirol Könnyen oxidálódik, teszi hozzá a halogének. polimerizált (így egy szilárd anyagot kapunk, üvegszerű massza - polisztirol) és kopolimerizált különböző monomerek. Polimerizáció lejátszódik szobahőmérsékleten (néha robbanás), úgy, hogy a tárolás során a sztirol stabilizált antioxidánsokat (például, tretbutilpirokatehinom. Hidrokinon). Halogénezés, például úgy, brómmal, ellentétben anilin nem beszél a benzolgyűrűn, és a vinil-csoportot alkotnak 1,2 dibrometilfenil.
Sztirol szinte kizárólagosan használt előállítására polimerek. Számos típusú sztirol-alapú polimerek a polisztirol. -sztirolozott poliészterek, ABS (akrilnitril-butadién-sztirol) és a SAN (sztirol-akrilnitril). Szintén szerepel a sztirol napalm.
Propilén (propén) CH 2 = CH-CH 3 -nepredelny (telítetlen) etilén uglevodorodryada, éghető gáz. Gyógyszer narkotikus hatás erősebb, mint uetilena. Veszélyességi osztály - a negyedik. [1].
A propilén egy gáznemű anyag alacsony forráspontú fp = -47,7 ° C és olvadáspontja op = -187,6 ° C, az optikai sűrűség 4 d20 = 0,5193.
kémiai tulajdonságok
Ez jelentős reakcióképesség. Kémiai tulajdonságai határozzák meg a szén-szén kettős kötést tartalmaz. p-kötést, mint a legkevésbé tartós és olcsóbb, míg az intézkedés a reagens megtört, és a felszabadult vegyértéke szénatomot költenek összekötő atomok teszik ki a molekula reaktáns. Minden kapcsolási reakciót folytassa a kettős kötés, és abból áll, hasító π-alkén kommunikáció és az oktatás a földön törés két új σ-kötések.
A leggyakoribb mellékhatások csatlakoznak az heterolitiku típus, amely elektrofil addíció.
Csatlakozási halogénatom (halogénezés)
A halogénezési reakciót általában valamely oldószerben, a szokásos hőmérsékleten. A halogének könnyen csatlakozik a helyén törés a kettős kötést alkotnak digalogenoproizvodnyh. Ez könnyebb kapcsolatot a klór és bróm, nehezebb - jódot. A fluor reagál robbanásszerűen.
Emellett a hidrogén (hidrogénezési reakció)
Hidrogén hozzáadásával a katalizátorok jelenlétében (Pt, Pd, Ni), propén telítődik szénhidrogén - propán.
Vízcsatlakozás (hidratálási reakció)
Propilén reakcióba lép a vízzel alkotnak egy monoalkohol izopropanolt, ahol a kettős kötés ismertet.
Csatlakozási halogenidek (HHal)
Akkor következik be, Markovnyikov szabály. Hidrogén HHal savat csatlakozik a legtöbb hidrogénezett szén atom a kettős kötést. Ennek megfelelően Hal maradékot kötődik ahhoz a szénatomhoz, amelynél a minimális számú hidrogénatomok.
Példa gidrogalogenirovaniya - megszerzése a bróm-propán a reakcióban propilén bromovodorodai.
] Az égési levegő
Mivel az oxigén a levegőben, propilén gázzal robbanó keverékeket képez.
A semleges vagy gyengén lúgos vizes közegben propilén oxidáljuk kálium-permanganát, amely mellé elszíneződése és képződése KMnO4-oldatot glikolok (vegyületek a két hidroxilcsoport szomszédos szénatomhoz kapcsolódó). Ezt a reakciót nevezzük Wagner reakciót.
Reakciókörülmények: hő, katalizátorok jelenlétében. A vegyület molekula fordul elő hasításával intramolekuláris π-közlemény és az újabb intermolekuláris σ-kötések, a.
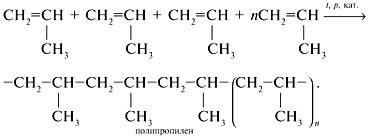
Levegőn oxidálódik oxigén propilén-oxid
Amikor jelenlétében hevítjük ezüst katalizátorok:
1. A hasítást a hidrogén-halogenidnek az alkil-halogenidek hatására alkoholos lúgos oldat:
2. A hidrogénezést propin jelenlétében a katalizátor (Pd):
3. Kiszáradás izopropanol (víz eliminálása). A katalizátort savat (kénsavat vagy foszforsavat) vagy Al2 O3:
4. A hasítás két halogénatommal digalogenoalkanov halogéntartalmú szomszédos atomok C. A reakció hatására a fémek (Zn, stb):