fázisátalakulás
Fázis a gyűjtemény egységes, azonos részeik a rendszer tulajdonságait. Bizonyos körülmények között (p és T) két különböző fázisa ugyanazon anyag egyensúlyban létezik. Van is a pont, ahol a három fázis egyensúlyban lehetnek, (hármas pont). Az átmenet az egyik fázisból a másikba az úgynevezett fázisátmenet. Fázisátalakulások kíséri az abszorpciós vagy hőfelszabadulással (látens hője fázisátmenet) nevezett fázisátalakulások az első fajta. Van is egy másodrendű fázisátalakulások amelyben nincs felszívódás vagy hőfelszabadulással, és néhány paraméter hirtelen változás (átmenetek közötti kristálymódosulatok, az átmenet a szupravezető állapotba, stb).
folyadék átmeneti gázállapotban nevezzük párolgás. a fordított folyamatot nevezik kondenzáció. Az átmenet a gáz halmazállapotú szilárd nevezzük szublimáció.
Heat q, amelynek be kell jelenteni, hogy a készülék súlya az anyag annak érdekében, hogy alakítani a gőz, található ugyanazon a hőmérsékleten, amely az anyag elpárologjon az úgynevezett specifikus párolgási hőt (vagy szublimációs). Amikor a kondenzációs hő venni a párolgási képhez Fordítva során képződő kondenzációs folyadék (vagy szilárd) melegítjük.
Bepárlás (szublimációs) fordul elő, amíg az egyensúlyi között a gáz és a folyékony (és a gáz-szilárd anyag). Amikor egy bizonyos nyomással egy adott hőmérsékleten, a molekulák száma, így a folyékony és a visszatérő, hogy legyen egyenlő. Ettől a ponttól, gőz sűrűség már nem változik. Között folyadék és gőz jön létre dinamikus egyensúly, amely léteznek, amíg nem fogja megváltoztatni a mennyiségét vagy hőmérsékletét a rendszer. A gőz, amely dinamikus egyensúlyban van a folyadék, az úgynevezett telített. A nyomás, amelyen egyensúlyi bekövetkezik, az úgynevezett nyomás (vagy rugalmasság) telített gőz. A telített gőz nyomása a hőmérséklettel növekszik.
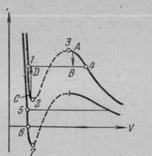
Tekintsük a folyamat a gáz kompressziós állandó hőmérsékleten (azaz, megkapjuk a valódi gáz izoterma). Kezdetben legalább csökkenteni a gáz térfogatát nyomás emelkedik (1. ábra). Amikor elérte a térfogata Vr nyomás megszűnik változhat és részben a gáz folyadékká kondenzálódik. Anyag elválasztás történik két szakaszban: egy folyékony fázist és egy gáz-halmazállapotú. Mivel a további mennyiségének csökkentése egyre nagyobb része a gáz bejut a folyékony fázis, ahol az átmenet bekövetkezik állandó nyomás CHP (telített gőz nyomása). Posletogo anyagként kondenzációs folyamat befejeződik (amikor a térfogat Vl), további térfogat csökkentése kezdődik kíséri gyors nyomásnövekedés.
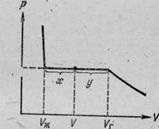
A tömegarány a folyékony és gőz kétfázisú állapotban van az arány a szegmensek, mely elválasztja a vízszintes része izoterma pont képviselő állam.
A 2. ábra a izotermák több hőmérsékleten. Az ábra azt mutatja, hogy a hőmérséklet növelésével izoterma vízszintes részét csökken, húz egy pont, az úgynevezett kritikus pont. Amely megfelel a hőmérséklet Ta. kötet Ver. PKR nyomás is nevezik a kritikus értéket. Vegye figyelembe, hogy a hőmérséklet növelésével csökken a folyadék sűrűségét, és a telített gőz van növelve, és a kritikus pontja közötti különbség a folyadék és a telített gőz eltűnik (folyadék és gőz sűrűség egyenlővé válik). A gáz a kritikus hőmérséklet felett nem lehet átalakítani folyékony
A fogalom a kritikus hőmérséklet volt először D. I. Mendeleevym. Nevezte el az abszolút hőmérséklet a forrásban lévő folyadék, és tekinthető a hőmérséklet, amelynél a tapadó erő eltűnik a molekulák közötti és a folyékony fordul gőz.
3. ábra eltakarja valós izoterma izoterma és van der Waals-erők. Összehasonlítása alapján izotermák Van der Waals-erők és a tényleges izoterma ez azt jelenti, hogy azok körülbelül azonos a megfelelő területeken egyfázisú állapotban az anyag (gáz és folyadék), de nagyon eltérően viselkednek a szétválasztás két fázisban (ahol vannak a telített gőz és folyadék) . Ahelyett, hogy az S-alakú curl izoterma Van der Waals igazi izoterma rendelkezik ezen a területen, egyenes és vízszintes részét.