Biológia diákok - 27
A kinetikája enzimes reakciókat. A kinetikai vizsgálatok gyorsítsa mechanizmusok reakciók és a tényezők hatását, mint például a koncentrációja az enzimek és szubsztrátok, tempera-utazás, pH, az inhibitorok jelenlétében, vagy aktivátorok.
Állandó koncentrációjú szubsztrát a reakció sebesség közvetlenül arányos az enzim koncentrációja. A telek a sebességét az enzimatikus reakció con-központosítás a hordozón van a forma egy egyenlő oldalú hiperbola.
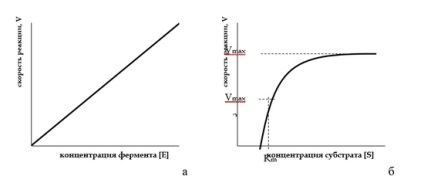
A függését sebességének enzimatikus reakció egy enzim koncentrációja (a) és (B) szubsztrátummal
Függése enzimatikus reakció sebességét a szubsztrát koncentrációja által leírt Michaelis - Menten egyenlet.
ahol V - egy álló sebesség biokémiai reakciók; Vmax - maximális sebesség; Km - Michaelis konstans; [S] - koncentrációban bepárlás szubsztrát.
Ha a szubsztrát koncentráció alacsony, azaz. E. [S] <<Кm, то [S] в знаменателе можно пренебречь.
Így, közvetlenül arányos közi-szubsztrát koncentrációk és leíró JELÖLI elsőrendű egyenletet alacsony szubsztrátum koncentráció-Rep reakció sebességét. Ez a ko-os állás, hogy a kezdeti egyenes vonalú tanítási-stku [S] görbe V = f (b ábra).
Magas szubsztrátum koncentrációk [S] >> Km ahol Km elhanyagolhatóak, az egyenlet a Michaelis - Menten egyenlet formájában, azaz a V = Vmax.
Így, nagy koncentrációban a szubsztrát a reakció sebessége vitsya STAN leírt maximális és nulladrendű egyenletet. Ez megfelel a részénél a görbén V = f [S], párhuzamosan az abszcisszán.
A szubsztrát koncentrációk numerikusan összehasonlítható állandó Michaelis-on, a reakció sebessége fokozatosan nő. Ez összhangban van a fogalmak a mechanizmus az enzim rea-CIÓ:
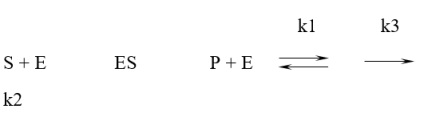
ahol S - a szubsztrát; E - enzimet; ES - enzim-szubsztrát komplex-Lex; P - termék; K1 - konstans képződési sebességét az enzim-szubsztrát komplex; k2 - a bomlási sebességi állandója az enzim-szubsztrát komplex kialakulását a kiindulási reagensek; K3 - bomlási sebességi állandó az enzim-szubsztrát komplex wi-mations terméket.
Az arány a szubsztrátum konverziója, hogy egy termék (P) arányos a koncentráció a pro-enzim-szubsztrát komplex [ES]. Alacsony koncentrációjú szubsztrát az oldatban számos szabad molekulák az enzim (E) nem kapcsolódik a komplex (ES). Ezért, koncentrációjának növelésével a szubsztrát koncentráció növeli com-eret tehát növeli és a képződés sebessége produk-ta. Magas szubsztrátum koncentrációk az enzim molekulák minden a komplexhez kötött ES (enzim telítési jelenség), úgy, hogy távolság-ther növekedése a szubsztrátum koncentrációja nem növeli, gyakorlatilag Vaeth koncentrációja és aránya a komplexek képződését, a termék állandó marad.
Így, világossá válik, fizikai értelmében a maximális sebesség az enzimatikus reakció. Vmah - az a sebesség, amellyel az enzim reagál teljesen formájában létezik az enzim-al-stratnogo komplex.
A Michaelis-állandó numerikusan megfelel egy Concentra-TION a hordozó, amely az egyensúlyi sebességnek van félmaximális. Ez az állandó jellemzi a con állandóit disszociációja az enzim-szubsztrát komplex:
A fizikai értelmében a Michaelis-állandó, hogy polarizálja a jellemzők, a affinitása az enzim a szubsztrátumot. Km van kis értékeket, amikor k1> (k2 + k3), azaz a komplex képződését transzformációk ES-over folyamatok rendelkezik ES disszociációs. Következésképpen, a kisebb a K m értékek, a affinitása az enzim a szubsztrát több. És megfordítva, a száj, ha Km nagy jelentősége van, a (k2 + k3)> k1 és ES disszociációs folyamatok érvényesülnek. Ebben az esetben, az affinitása az enzim a szubsztrát kicsi.
Inhibitorok és aktivátorok enzimek. Enzim-inhibitorok olyan anyagok, amelyek csökkentik az enzimaktivitást. Bármely denaturáló ágensek (például, nehézfémek sói, savak) nem specifikus ingibito-beállított enzimek.
Reverzibilis inhibitorai - olyan vegyületek, amelyek nem-kovalens kölcsönhatásba lépnek az enzim. Irreverzibilis inhibitorok - olyan vegyületek specifikusan kötő funkciós csoport az aktív centrum és a kovalens kötések az enzimmel.
Reverzibilis kompetitív gátlás és elválasztjuk a bérleti-nekonku. Kompetitív gátlás magában foglalja a strukturális konvergáló-TION inhibitor és a szubsztrát. Inhibitor zajlik az aktív oldalon az enzim, és jelentős számú enzim molekulákat nevezik egy szem-blokkolt. Kompetitív gátlás lehet távolítani, ha emelése a szubsztrát koncentráció. Ebben az esetben a hordozót zsúfoltság akkor kompetitív inhibitora az aktív hely.
Reverzibilis gátlás lehet kompetitív kapcsolatban-SRI szubsztrát. Ebben az esetben, az inhibitor nem versenyez a kötőhelyét az enzim. Szubsztrát és inhibitor kötődnek időt-TION központok, így fennáll a lehetősége olyan komplexet képez, IE valamint terner komplex IES, amely adható, bomlik a kibocsátást a termék, de lassabban, mint Comp Lex ES.
A természet a keresete gátlók vannak osztva:
Specifikus inhibitorok fejtik ki hatásukat az enzimre, összekötő kovalens kötés az aktív oldalon az enzim és a forgatva hatálya alól.
A nemspecifikus gátlása magában foglalja az expozíció a fer-MENT denaturáló szerek (nehézfémsók, karbamid, stb). Ebben az esetben, a megsemmisítés kvaterner és terc-sósav fehérje szerkezet egy a biológiai aktivitás elvesztését az enzim.
Aktivátorok enzimek - olyan anyagok, amelyek növelik a sebessége a Fermi-kommutatív reakciót. Leggyakrabban aktivátorként működnek fémionok fogási (Fe2 +, Fe3 +, Cu2 +, Co2 +, Mn2 +, Mg2 +, stb). Különböztesse fémek az összetétel metalloenzimek amelyek kofaktorok, és te-léptetéssel, mint aktivátorok enzimek. Kofaktorok szoros kapcsolat-vatsya a fehérje része az enzim, mint a promóterek, ezek könnyen elválasztjuk a apoenzim. Ezek a fémek kötelező felhasználói km katalitikus meghatározó eseményt enzim aktivitását. Aktivátorok Wuxi Libanon-katalitikus hatást. de ha ezek nincsenek nem zavarja Protek-NIJ enzimes reakciót. Jellemzően, a fém-kofaktor kölcsönhatásban áll a negatívan töltött csoportokat a szubsztrát. Fém változó vegyértékű részt vesz a cseréjét elektronok a szubsztrátum és az enzim. Ezen túlmenően, hogy részt vesznek a kialakulása egy száz DOBBAL átmenetet konformációját az enzim, amely hozzájárul a gyorsabb képződése mu-ES komplex.
Rendelet az enzim aktivitását. Az egyik alapvető mechanizmusainak metabolikus szabályozás szabályozás az enzim aktivitását. Egy példa erre a allosztérikus szabályozás, szabályozás aktivátorok és inhibitorok. Gyakran előfordul, hogy a végtermék útvonal egy inhibitora a szabályozó enzim. Ez a típusú gátlás hívják visszajelzést gátlás, vagy gátlása negatív visszacsatolás.
Sok enzimet állítanak elő, mint az inaktív predshe-stvennikov-pro-enzim, majd aktivált a megfelelő pillanatban a részleges proteolízis. Részleges proteolízis - hasítását a molekula, ami egy változás a harmadlagos szerkezetét a fehérje és kialakulását az aktív centrum az enzim.
Egyes enzimek oligomerek módosíthatja tevékenységüket az egyesület - disszociációja alegységek. belül együttes egyre.
Számos enzim két formában: a pro-fehérjét és a szemcsés, mint fosfoproteida. Az átmenet egyik formából a Dru-Guyu megváltozása kíséri a katalitikus aktivitás.
A sebessége enzimatikus reakció függ az enzimmennyiség. amely egy sejtben határozzuk meg sebességű aránya a szintézis és a pusztulás. Ez a módja sebességének szabályozására enzimatikus reakció lassúbb folyamat, mint a szabályozás a aktivitásának Fer-ment.