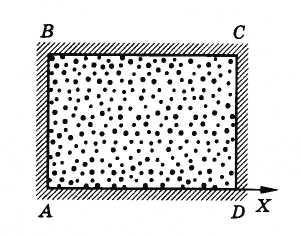
Az átlagos négyzetes sebesség értéke
Mi érdekli az átlagos a sebesség négyzetével vetítés. Ez ugyanaz, mint a sebesség négyzet modulusa (lásd a kifejezés (4.1.2).)
molekulák sebesség vegye folyamatos értéktartomány. Határozza meg a pontos sebesség és számítsuk ki az átlagos értéket (statisztikai átlag) Képlet (4.3.2) szinte lehetetlen. meghatározzák
* Arról, hogy hogyan ezeket a számokat lehet meghatározni, akkor tárgyaljuk §4.6.
Mivel az X irány ugyanaz, mint Y, és Z irányban (újra, mert a káosz a mozgását molekulák), az egyenletet:
A tér a sebessége minden molekula egyenlő:
Az érték a közepes négyzetes sebesség, meghatározva, valamint a közepes négyzetes sebessége nyúlvány (lásd általános képletű (4.3.2) és (4.3.3).) A négyzetének összege annak másodlagos nyúlványok:
A kifejezést (4.3.4) és (4.3.5) az következik, hogy
T. E. Sredny négyzet sebesség kivetítés
Sebesség molekulák változhat véletlenszerűen, de az átlagos értéke a sebesség vetítési bármely irányban és az átlagos négyzetes sebesség - meghatározott érték.
§ 4.4. A alapegyenletének molekuláris kinetikai elmélet
Kiszámítjuk a molekuláris kinetikus elméletét gáznyomás. Alapján az elvégzett számítások azt is, hogy egy nagyon fontos következtetést a gáz hőmérséklete miatt az átlagos kinetikus energia a molekulák.
Tegyük fel, hogy a gáz egy négyszögletes tartályban szilárd falak. Gáz és edény hőmérséklete azonos, T. E. állapotban vannak a termikus egyensúly. Feltesszük molekuláris ütközések a falak teljesen rugalmas. Ilyen feltételek mellett a kinetikus energia a molekulák ütközés nem változik.
Az a követelmény, hogy az összecsapások voltak teljesen rugalmas, nem feltétlenül szükséges. Pontosan nem hajtják végre. Molekulákat is tükröződik a falakon különböző szögekben és sebességekkel, amelyek nem egyenlő modulo sebessége az ütközés előtt. De az átlagos kinetikus energiája a visszavert fal molekulák egyenlő lesz a kinetikus energia a beeső molekulák, hacsak nem áll fenn a termikus egyensúly. A számítási eredményeket nem függ részletes képet a molekulák a fal ütközések. Ezért, akkor megengedett, hogy úgy ütközés molekulák ilyen ütközések rugalmas golyót tökéletesen sima, tömör falú.
Kiszámoljuk a gáznyomás a CD tartály fala, amelynek területe S és merőleges X tengely (ábra. 4.3).