Az arány a kémiai reakció, a készítmény a DH és a vizsga a kémiában
Az arány a kémiai reakció - a-nenie mérhető reaktánsok koncentrációja időegység.

Amikor homogén reakciók reakció térben jelöli a mennyiség a reakcióedénybe, és a heterogén - a felület, amelyen a reakció végbemegy. A koncentráció a reagáló anyag-összetevők általában kifejezve mol / l - hány mól anyag 1 liter oldat.
A kémiai reakció sebessége függ a természet a reagensek, a koncentráció, hőmérséklet, nyomás, érintkező felületi anyagok és annak jellegét, katalizátorok jelenlétében.
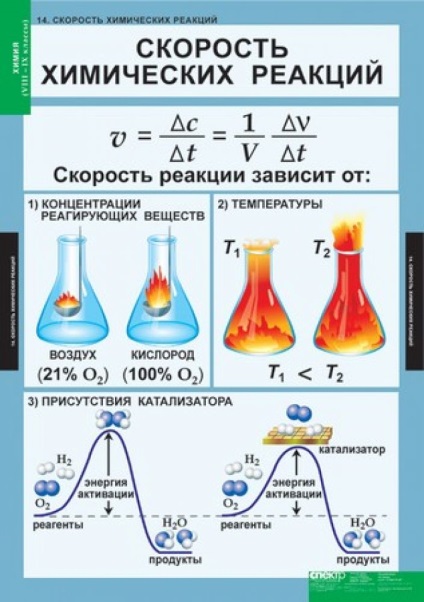
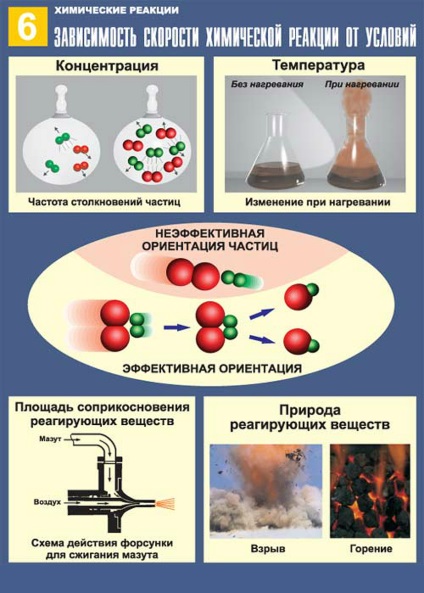
Növekvő koncentrációjú anyagok lépő kémiai kölcsönhatás növeli a kémiai reakció sebességét. Ez azért van, mert az összes kémiai reakciók között zajlik számos reaktív részecskék (atomok, molekulák, ionok). A nagyobb részecskék a reakciótér térfogata térben, annál gyakrabban ütköznek, és van egy kémiai kölcsönhatás. A kémiai reakció révén valósul meg egy vagy több elemi események (ütközések). tudjuk írni expresszióját reakciósebesség a reaktánsok koncentrációja alapján a reakció egyenlet. Ha a játék az elemi esemény csak egy molekula (bomlik reakció), a függőség-híd lesz a következő formában:
Ez az egyenlet unimolekulás reakciót. Amikor az elemek egy tára-hatnak a kölcsönhatás a két különböző mól-molekulák, a függőség a forma:
Ez az úgynevezett bimolekuláris reakciót. Az ütközés esetén három molekula kifejezés érvényes:
A reakciót nevezzük trimolekuláris. Megnevezések tényezők:
V- reakció sebességét;
[A], [B], [C] - reaktánsok koncentrációja;
k - arányossági tényező; úgynevezett con-állandóit a reakció sebességét.
Ha a reaktánsok koncentrációja egyenlő egy (1 mol / l), vagy hogy a termék egyenlő eggyel, akkor v = k. Állandó függenek szitán sebességű a reaktánsok jellegétől és a hőmérséklet. A függését sebességének egyszerű reakciók (.. Ie fellépő keresztül egy elemi esemény) a koncentráció által leírt tömeghatás törvénye: SKO-növekedés egy kémiai reakció egyenesen arányos a termék a reagáló anyagok koncentrációit, kosár-REFERENCIA mértékben azok sztöchiometriai együttható-nek .
Például, elemzik a reakció 2NO + O2 = 2NO2.
Abban az esetben, ha a kémiai reakció egyenlet nem felel meg elemi aktus kölcsönhatás, és tükrözi, csak a kapcsolat a tömeg és az el nem reagált anyagok képződött, bizonyos mértékben koncentrációkban nem lehet egyenlő az együtthatók szemben a képletek az anyagok a reakcióegyenlet-SRI. A reakcióban, több szakaszban, a reakció sebessége op redelyaetsya leglassabb (sebességmeghatározó) lépésben.
Ez a függőség reakció sebessége a con központosítás a reagensek érvényes gázok és reakciók zajlanak megoldás. Igénylő reakciókat szilárd nem tartozik a tömeghatás törvénye, mivel a molekuláris kölcsönhatás lép fel csak a felső felületen felület. Következésképpen, a sebessége a heterogén reakcióelegyet is függ a mérete és jellege a felület-TION soprikosnove reagáló fázisok. Minél nagyobb a felülete - a reakció gyorsabban fog menni.
A hőmérséklet hatása a sebességet a kémiai újra akció
A hőmérséklet hatása a kémiai reakció sebessége határozza meg van't Hoff szabály: minél magasabb-SRI hőmérséklet minden 10 ° C-on a reakció sebességét-Uwe lichivaetsya 2-4 alkalommal. Matematikailag ez általában újra adni a következő egyenlet:
ahol VT1 és vt2 - reakciósebesség a TEM-középhõmérséklete t2 és t1; g - a hőmérsékleti együttható - számos-vayuschee mutatja, hogy hány alkalommal a reakciósebesség növekszik a hőmérséklet növekedésével, az egyes 10 ° C-on ilyen jelentős függését a kémiai reakció sebessége a hőmérséklet annak a ténynek köszönhető, hogy a kialakulását új vegyületek egyáltalán nem com ütközés a reagáló molekulák. Csak azok a molekulák kölcsönhatásba lépnek (aktív molekula), Koto-rozs rendelkezik elegendő energiával, hogy megtörjék a kötvények a prekurzor részecskék. Ezért minden egyes reakciót az jellemzi, hogy az energia gáton. Annak leküzdését molekula-ment aktiválási energia szükséges - néhány Redundáns energia, amely rendelkezik egy molekula annak ütközés egy másik molekulához eredménye egy új anyag. Növekvő hőmérséklettel, az aktív molekulák gyorsan növekszik, ami a meredeken-edik reakció sebességét növeli a van't Hoff-szabályt. Az aktiválási energia egy adott reakció természetétől függ a reagensek.
Az elmélet az aktív ütközések tudja magyarázni a hatása néhány tényező az arány a kémiai reakció. A főbb rendelkezések az elmélet:
- A reakciók fordulnak elő reaktáns ütközés a részecskék, amelyek egy bizonyos energia.
- Minél nagyobb a részecske-reagens, a közelebb vannak egymáshoz, annál nagyobb az esély, hogy meg kell néznie, és reagálni.
- Ahhoz, hogy a reakció vezető egyetlen hatékony ütközések, azaz amelyekben a törött vagy meggyengült „régi kapcsolatok”, és ezért képezhetnek az „új”. Ebből a célból, a részecskék kell rendelkezik elegendő energiával.
- Minimális felesleges energia szükséges a hatékony hatását reagens részecskék, úgynevezett aktiválási energia Ea.
- vegyipari tevékenység nyilvánul meg a kis aktiválási energiája reakciók részvételüket. Az alsó az aktiválási energia, annál nagyobb a reakciósebesség. Például, a reakciók nagyon kicsi a kationok és anionok aktiválási energia, ezért az ilyen reakciók jelentkeznek szinte azonnal
Effect katalizátor
Az egyik leghatékonyabb eszköz a befolyásolása a sebesség kémiai reakciók - a katalizátorok alkalmazásával. Katalizátorok - anyagokat, amelyek megváltoztatják a reakció sebessége, valamint magukat a végén a folyamat ugyanaz marad a készítményben és a súly. Más szavakkal, abban az időben a reakció katalizátor aktívan részt vesz a kémiai pro-átengedés, de a végére a reakció reagenseket megváltoztatják kémiai összetételét, fordult termékek, és a katalizátort elrendezve az első, eredeti formájában. Általában egy katalizátor növelni a reakció sebességét, bár néhány katalizátorok nem gyorsítani, és lassítja a folyamatot. A jelenséget a gyorsulás kémiai reakciók miatt a katalizátor jelenlétében úgynevezett katalízis és lassítás - gátlás.
Bizonyos anyagokat nem katalitikus hatása, de azok additív drámai módon megnöveli a katalitikus képességét a katalizátort. Ezek az anyagok az úgynevezett támogatói. Egyéb anyagok (katalizátor mérgek) csökkenti, vagy akár teljesen blokkolni az intézkedés a katalizátorok, a folyamatot nevezik a katalizátor-mérgezés.
Kétféle katalízis: homogén és heterogén. Amikor homogén katalízis reaktánsok, termékek és a katalizátor képeznek egyfázisú (gáz vagy folyadék). Ebben az esetben nincs túlzott Ness felület között katalizátorral és a reagensekkel.
A különlegessége heterogén katalízis, hogy a hengerelt-torlódások (jellemzően szilárd anyag) vannak egy másik fázisban-SRI álló, mint a reagensek és a termékek a reakció. A reakciót általában fejlődik a szilárd felületen.
Amikor a kialakítási A homogén katalízis intermedierek között a katalizátor és a reakció-reagens a reakcióban egy alacsony aktivációs Ener-ology. A heterogén katalízis sebessége reagálva nő az magyarázza, adszorpciós-összetevőjű anyagok a katalizátor felületére. Ennek eredményeként, ezek koncentrációja növeli a reakció sebessége megnő.
Egy különleges eset a autokatalízisseí Katalízis. Jelentése abban a tényben rejlik, hogy a kémiai folyamat gyorsítható egyik pro-reakció termékek.
Példák problémák megoldásához a reakció üteme