Az aktiválási energia fogalmát
Pontosabban, a függőség a reakció sebességi állandója a hőmérséklet által leírt Arrhenius-egyenlet:
,
Ha a hőmérséklet változik a reagensek koncentrációja állandó marad, a függőség a reakció sebessége a hőmérséklet által leírt egyenlettel:
- bázis a természetes alapú logaritmus;
- reakció aktiválási energiája, J / mol;
- egyetemes gázállandó J / mol · K;
Az aktiválási energia - a minimális kiegészítő vagy többlet energia képest az átlagos energia a reagáló faj, amely rendelkezik azzal a ütköző részecskék reagálni. Részecskék ilyen energia nevezzük aktív. Az aktiválási energia a folyamat jellegétől függ a reagensek. Az értékek a aktiválási energiákat a reakciók között lehet 40 és 200 kJ / mól.
Az aktiválási energia (Ea) azt mutatja, milyen minimális energia (1 mól) a részecskék kell, hogy azok képesek reagálni.
- ha az EA <40 кДж/моль, то значительная часть столкновений молекул приводит к реакции и скорость велика.
-ha 40 <Еа <120 кДж/моль скорость удобно меняется.
-ha Ea> 180 kJ / mól. a reakció nagyon lassan.
A koncentráció az energia diagram mutatja az Arrhenius
Fordított endoterm reakció:
H2 (T) + J2 (R) 2HJ; # 8710; H 0 p (T) = 54 kJ.
Maxwell eloszlás - Boltzmann:
Normális körülmények között, csak egy része a molekulák rendelkezik elegendő energiával, hogy leküzdeni a küszöböt. Ahogy a hőmérséklet ilyen molekulák válnak, és a reakció sebessége megnő. Ismeretes, hogy a gázmolekulák egy adott hőmérsékleten van egy eltérő kinetikai energia által leírt Maxwell-Boltzmann-eloszlás |:
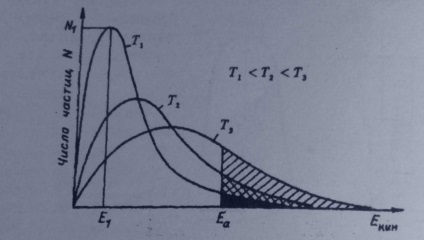
Grafikonok a részecskeméret-eloszlás energiák különböző hőmérsékleteken azt mutatják, hogy a hőmérséklet növelésével, az ilyen molekulák száma növekszik. Pontosabban állandó a hőmérséklet függvényében a kémiai reakció sebessége által leírt egyenlettel.
A Arrhenius-egyenlet, hogy amikor k = k0 Ea = 0. Feltételezhető, hogy ezen feltételek mellett, minden egyes részecske ütközés vezet kémiai reakció. A gázok kinetikus elméletét lehetővé teszi, hogy kiszámítja a száma részecskeütközéseket időegységenként (z). A tapasztalat azt mutatja, hogy nem minden találkozás még aktív molekulák vezet reakciót. Meg kell még egy állapota a reakció áramlás - definiált molekuláris orientáció előnyben újraelosztása az elektronsűrűség. Ezért, a pre-exponenciális faktor k0 tartalmaz molekuláris orientációs faktor (valószínűség faktor) Rohr:
Valószínűség tényező csökken növekvő száma és összetettsége a reagáló fajok egy részvény 10-9.
Így a pre-exponenciális faktor tükrözi a kollíziós frekvenciát és orientációja a reagáló részecskék.
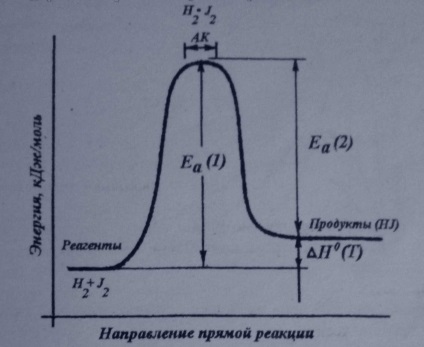
Az energia diagramja a kémiai reakciók:
Az energia diagramja a reakció termék AB képződését a kiindulási anyagok A és B Ha az energia az ütközés a molekulák A és B jelentése nagyobb vagy egyenlő, mint az aktiválási energia Ea. Ez kiküszöböli az energia gáton, és a mozgás mentén megy végbe a koordináta R a reakciót a kiindulási anyagok a termék. Egyébként van egy rugalmas ütközés a molekulák A és B tetején a energia gát megfelel az átmeneti állapot (aktivált komplex), ahol a link A-B részben képződik.
6. Az aktivált komplex, annak tulajdonságait. (Példa)
A reakció kezdődik csak a részecskék közötti, amelyek nagy energiájú. Az ilyen részecskék ütköznek az első úgynevezett formában az aktivált komplex (AK). Ezután aktivált „komplex szétesik reakciótermékek. Oktatási AK energetikailag kedvezőbb, mint a összeomlása a molekulát atomokra, majd a kialakulását új kötések. Az ingatlan ak:,
1) AA nem kémiai vegyület.
2) AK-nak nagyon rövid idő alatt.
3) Egy reverzibilis reakcióját AK ugyanaz a közvetlen és
4) képződése reakció Ea hálózati.
A reakcióelegyet H2 + J2 aktivált komplex egy dimer lapos H2 * J2v ahol minden utalást úgy hosszabbítjuk képest a molekulák a kiindulási anyagok. A reverzibilis reakciókat, aktiválási energia különbözik az előre és hátra reakciókat. A különbség a aktiválási energiáját az előre és hátra reakciók a reakció entalpiája (H0 (T)), részecskék energia nagyobb vagy egyenlő, mint Ea úgynevezett aktív.