A víz, mint az oldószer oldhatóságát, tartalom platform
A víz, mint az oldószer oldhatóságát.
Víz - hidrogén-oxid (H2O) - az egyik leggyakoribb és legfontosabb anyagok. Tiszta víz a természetben - mindig tartalmaz szennyeződéseket. Tiszta víz lepárlással. A desztillált víz az úgynevezett desztillált. Víztartalom (tömeg): 11,19% hidrogént és 88,81% oxigén. Tiszta víz tiszta, szagtalan és íztelen. Azt a legnagyobb sűrűségű 0 ° C hőmérsékleten (1 g / cm3). Ice sűrűsége kisebb, mint a folyadék sűrűsége a víz, így a jég felszínén úszik. Víz megfagy 0 ° C-on forr 100 ° C-on nyomás alatt 101 325 Pa. Ő egy rossz hővezető, és egy nagyon gyenge elektromos vezető. Víz - jó oldószere. A vízmolekula szögletes alakja a hidrogénatomok oxigénnel szöget képezve a 104,3 °. Ezért, egy vízmolekula - dipól: az a része, a molekula, ahol jelentése hidrogénatom, pozitív töltésű és a részen, ahol az oxigén - negatív. Mivel a polaritását vízmolekulák disszociált elektrolitok ott. A folyékony víz és a szokásos H2O molekulák tartalmaztak kapcsolódó molekulákat, azaz. E. Kombinált több komplex aggregátumok (H2O) x képződése miatt a hidrogén kötések (ábra. 4). A hidrogén jelenléte a vízmolekulák közötti magyarázhatók rendellenességek fizikai tulajdonságai: sűrűsége legfeljebb 4 ° C-on, magas forráspontú (egy sor H2O - H2S - N2Se) abnormálisan nagy hőkapacitású (4,18 kJ / (g • K)). Növekvő hőmérséklettel, a hidrogén-kötések megszakadnak, és a teljes szakítást történik az átmenet a víz gőzzé.
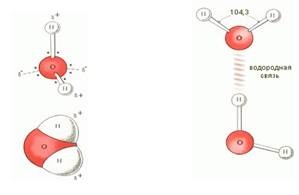
4. ábra: A vízmolekula
Solutions - homogén többkomponensű rendszer, amely egy oldószerben, az oldott anyagok és azok reakciótermékei. A Az aggregáció lehetnek folyékony oldatok (tengervíz), gáz-halmazállapotú (levegő) vagy szilárd (sok ötvözetek). Részecskemérete valódi oldatok - kevesebb, mint 10-9 m (kb molekuláris méretek). Ha a molekuláris vagy ionos részecskék eloszlása a folyékony oldatot van jelen benne olyan mennyiségben, hogy ilyen körülmények között további oldódás már nem az anyag, az úgynevezett telített oldat. (Például, ha teszünk 50 g nátrium-klorid 100 g H2O, majd feloldjuk 200 ° C hőmérsékleten csak 36 g só).
Ez az úgynevezett telített oldat, amely dinamikus egyensúlyban van feleslegben oldott. Elhelyezése 100 gramm vizet 200 ° C hőmérsékleten kevesebb, mint 36 g NaCl telítetlen oldatot kapunk. Melegítés hatására a só keveréket vízzel 1000C fordul elő feloldásával 39,8 g nátrium-klorid 100 g vízben. Ha most, majd az oldhatatlan sót az oldatból, és az oldatot óvatosan lehűtjük 200 ° C hőmérsékletre, feleslegben mennyiségű sót nem mindig kicsapjuk. Ebben az esetben van dolgunk, túltelített oldatban. A túltelített oldatot nagyon instabil. Keveréssel, rázással, sózzuk szemes okozhat kristályosításával felesleges só és az átmenetet a telített stabil állapotot. Telítetlen oldatot - tartalmazó oldat egy anyag kevesebb, mint telített. Túltelített oldatát - tartalmazó oldattal anyagokat nagyobb, mint a telített.
Solutions kölcsönhatásából képződik egy oldószer és oldott anyag. A folyamat a kölcsönhatás az oldószer és az oldott anyag szolvatációs nevezett (ha az oldószer víz, - hidratáció). Oldódás zajlik, így a különböző formájú és termékek Strength - hidrát. Amikor ez az erő részt a fizikai és kémiai jellegű. Az oldódási folyamat miatt az ilyen kölcsönhatások komponensek kíséri a különböző termikus jelenségek. Energia oldódási jellemzője a képződéshő az oldat, úgy, mint a algebrai összegét a hőhatás endo - és exoterm folyamat lépéseit. A legfontosabb közülük:
- hőelnyelő folyamatok - a megsemmisítése a kristályrács, megtöri a kémiai kötések a molekulák;
- hő-generáló folyamatok - képződését kölcsönhatás termékek az oldott anyag és az oldószer (hidrátok), és mások.
Ha a törési energia a kristályrács kisebb, mint a hidratációs az oldott anyag, az oldódás megy hőfejlődés (felmelegedés figyelhető meg). Így, feloldjuk NaOH - exoterm folyamat: a megsemmisítése a kristályrács kárba 884 kJ / mol, és a kialakulása hidratált Na + ionok és az OH - kiosztott rendre 422 és 510 kJ / mól. Ha az energia a kristályrács hidratációs nagyobb, az oldódás akkor történik hőabszorpcióval (a vegyületekből vizes NH4NO3 oldat hőmérsékletét csökkentő figyelhető).
Oldékonyság. Reserve oldhatóságát sok anyag a vízben (vagy más oldószerek) egy konstans értéket a koncentrációnak megfelelő telített oldat egy adott hőmérsékleten. Ez egy minőségi jellemzője oldhatóságot és a hivatkozásokat tartalmazott gramm per 100 g oldószer (bizonyos feltételek mellett). Oldhatóság természetétől függ az oldott anyag és az oldószer, a hőmérséklet és a nyomás.
1. A természet az oldott anyag. A kristályos anyagok vannak osztva:
P - nagymértékben oldódó (több mint 1,0 g-ot 100 g víz);
M - gyengén oldható (0,1 g - 1,0 g 100 g vízben);
H - oldhatatlan (kevesebb, mint 0,1 g 100 g vízben).
2. Az oldószer jellegét illetően. Amikor a kötés kialakulását a részecskék az oldat minden egyes komponens helyébe kötések részecskéi között különböző komponensek. Ahhoz, hogy új kapcsolatokat lehet kialakítani, az oldatot komponensek kell ugyanolyan típusú kapcsolat, azaz a. E. Legyen az azonos jellegű. Ezért az ionos anyagok oldódik poláris oldószerekben, és gyengén nem-poláros, és a molekuláris anyagok - fordítva.
3. A hőmérséklet hatása. Ha az oldott anyag egy exoterm folyamat, majd a hőmérséklet növelésével az oldhatóság csökken (például Ca (OH) 2, vízben), és fordítva. A legtöbb jellemző sók oldhatóságának fokozása melegítés (ábra. 5). Gyakorlatilag az összes a gázokat oldott exoterm. Az oldhatósági gázok és folyadékok növekvő hőmérséklettel csökken és csökkenő növekszik.
4. Hatás a nyomás. A növekvő nyomás a oldhatóságát gázok folyadékokban növeli és csökkenti a csökkenő.
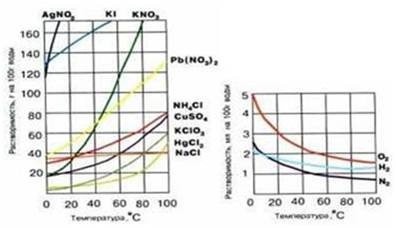
5. ábra a hőmérséklet összefüggése oldódó anyagoknál