A szerkezet a peptid-csoport
A peptid-kötés a kémiai jellegű, és kovalens kötéssel kapcsolódik a nagy szilárdságú elsődleges szerkezetének a fehérje molekula. Mivel az ismétlődő egység a polipeptid-lánc, és amelynek az a sajátságos jellemzői a szerkezet, a peptid kötést érinti nemcsak az alakja a primer szerkezet, hanem a magasabb szintű szervezet a polipeptid-lánc.
A peptid (amid) csoport az eredeti jellegzetes szerkezetű.
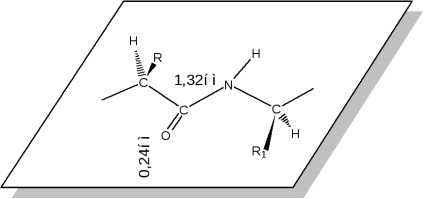
Mind a négy atom - N, C, OiCraspolagayutsya síkban, hogy otvechaetsp 2 hibridizációs szénatomokból és az oxigén a karbonilcsoport. Nem megosztott elektronpárt a nitrogénatom vesz s pár elektronok a kettős kötés a karbonilcsoport. Ennek eredményeként, a C-NB peptidek és proteinek jelentősen lerövidül, és a kettős kötés a C = O meghosszabbodik. Abból a szempontból az elektronikus szerkezet a peptid-csoport egy három-center p--konjugált rendszer, ahol az elektronsűrűség irányába van eltolva egy elektronegatív oxigén atom. Így vannak nagy elektron (atom = O), és elektron akceptor tulajdonságok (N atom a nitrogén), amelyek élesen kapacitásának növelése ezen atomok a hidrogénkötés, amely előfordul miatt a legfontosabb tulajdonság a fehérjék - forma szerkezetek végtelenül változatos formái:
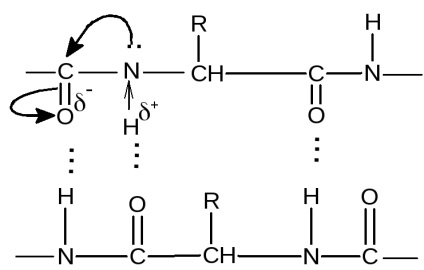
Mindegyik peptidet csoport képezhet két hidrogénkötéseket más csoportokkal, beleértve a peptidet. Kivételek peptid képzett csoportok részvételével az aminosavak prolin vagy hidroxi-prolin, amelyek képesek alkotnak csak egy hidrogén kötést. A peptid-lánc olyan helyen, ahol a prolin vagy hidroxi-prolin, könnyen hajlítható, mivel nem marad vissza a szokásos módon, egy második hidrogénkötés.
Ennek eredményeként az a tény, hogy a peptid-kötés létezik a keto-enol forma (jelenlétében lapos konjugált rendszer)
körüli elforgatás a C-N-kommunikáció tilos és az összes atom szerepel a peptid csoport transz-konfigurációban. Cisz-konfigurációban energetikailag kedvezőtlenebb, és már csak néhány gyűrűs peptidek.
A kompozíció a polipeptid lánc merev szerkezeti elemek (lapos peptid csoport) váltakoznak viszonyítva mozgatható rész (-SNR), amelyek képesek forgatni körül kötvények, bár az ilyen forgás lehet meglehetősen korlátozott nehézségei miatt a térbeli eloszlását oldalláncok (R) aminosavat tartalmaz. Így, az elektronikus és sztérikus szerkezete a peptid csoportok befolyásolják hajtogatását a polipeptid-lánc az űrben, és mindenekelőtt, meghatározza a kialakulását fehérje másodlagos szerkezetét.
másodlagos szerkezet
A másodlagos szerkezet fehérjék egy olyan folyamat, a polipeptid láncot egy rendezett halmozási alakja miatt hidrogénkötés-rendszerben, vagyis meghatározzuk a térbeli orientációját a polipeptid lánc. Két formája a másodlagos szerkezet: helikális (-hélix) fordul elő, hogy egyetlen polipeptid-lánc, isloisto lapos (-szerkezet) - a szomszédos polipeptid láncok.
Bár helikális struktúra a polipeptid lánc fehérjék találhatók formájában az egyes részek, tulajdonít a fehérje molekula kellően nagy szilárdságú, ez okozza mind a proximális és disztális eljárás erők részt vesznek a létrehozását hidrogénkötések.
-Helix figyelembe veszi az összes tulajdonságait a peptid kötést, a konfiguráció egy helikális szimmetria. fordul a spirál rendszeres; az összes aminosav-maradékok a hélix gerincét függetlenül azonos a szerkezete ezek oldalláncai, az utóbbi nem vesznek részt a kialakulását -hélix. Az egyik vitke helix 3,6 aminosavat tartalmaz. A spirál lehet által leírt szekvencia
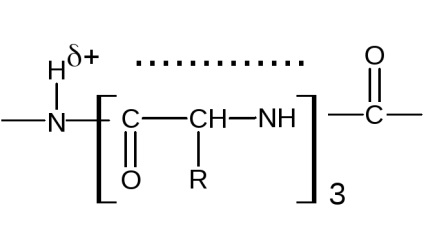
13 gyűrűatomot (R-aminosavak), ahol D ... H - hidrogén kötés.
Mindegyik peptid-csoport alkot egy hidrogén-kötést egy negyedik belőle figyelembe véve a peptid-csoport.
-Helix biztosít a legalacsonyabb feszültség csatlakozások, a minimális mérete szabad hely közelében, a tengely és minimális méretei a hélix tekercs. -Helix-ben fedezték fel a kristályos hemoglobin, és később - szinte minden globuláris fehérjéket.
Layered hajtogatott szerkezete (-szerkezet) van egy kissé ívelt alakú u-szénatom a polipeptid-lánc, és jön létre a láncok közötti hidrogénkötések.
-hajtogatott lap lehet kialakítva párhuzamosan a (N-végeket irányított azonos irányban) és antiparalel (N-végeket irányított különböző irányban) polipeptid-láncot. Hajtogatott szerkezetek találtak számos szerkezeti fehérjék (kollagén, keratin, selyem fibroin).
A beállított -hélixek i szerkezetek egy fontos kritérium, amelynek megítélni a mértékét sorrendben szerkezet a fehérjemolekula, a fehérjék stabilitása hatása által fizikai és kémiai tényezők környezetben.
két további szinteket alapján állapították meg az utóbbi kutatások globuláris fehérjék: szerkezete sverhvtorichnaya jellemző energetikailag előnyös egység másodlagos szerkezet idomeny - része a fehérje gömböcske amelyek kellően izolált globuláris régióban.
Sverhvtorichnaya szerkezet (szuperhélixben) - van együttesek kölcsönható másodlagos szerkezetek. A előfordulása az ilyen sávok azt jelzi, hogy ezek előnyös abból a szempontból sem a kinetikája koagulációs, vagy a szabad energia nyereség a már feltekeredett fehérjék. Superspiralizovannaya-hélix található rostos fehérjék.
Under domének általánosan érthető kompakt önálló suboblasti álló olyan fehérje minimális felület: térfogat arány, és hogy a számos funkcionális kötések a tartomány összetétel jelentősen meghaladja, hogy összehasonlítva a szomszédos domének. Jellemzően domainek különböző funkciókat látnak, és ezért nazyvayutfunktsionalnymi területeken.