A képlet az ideális gáz
Ahhoz, képletek és a fizika törvényei már könnyebb megérteni és használni mindenféle használt modellek és az egyszerűsítés. Ez a modell ideális gáz. Modell a tudomány - egy egyszerűsített példányát az igazi rendszer.
A modell tükrözi a lényeges jellemzőit és tulajdonságait a folyamatok és jelenségek. Az ideális gáz modell figyelembe veszi csak az alapvető tulajdonságait a molekulák, amelyek szükségesek, hogy ismertesse a viselkedése alapján a gáz. Az ideális gáz hasonlít valós gáz meglehetősen szűk tartományban a nyomás (p) és a hőmérséklet (T).
A legfontosabb egyszerűsítési az ideális gáz az, hogy a kinetikus energia a molekulák tartják, hogy sokkal nagyobb, mint a potenciális energia az interakció. Ismertesse az ütközés gázmolekulák útján jogszabályok rugalmas ütközés labdák. A mozgás a molekulák tartják egyenesen közötti szünetekben ütközések. Ezek a feltételezések lehetővé teszik, hogy szerezze be a külön egyenletet, amely az úgynevezett állapotegyenlet az ideális gáz. Ezek az egyenletek használhatók leírni az igazi gáz állapotban alacsony hőmérsékleten és nyomáson. állapotegyenlet, és lehet nevezni képletek ideális gáz. Itt is más alapvető formulák, amelyeket a vizsgálat során alkalmazott viselkedésének és jellemzőinek ideális gáz.
Állapotegyenlet az ideális
Egyenlet Mengyelejev - Clapeyron
ahol p - gáznyomás; V - a gáz mennyisége; T - gáz hőmérséklete Kelvin; m - tömege gáz; - a moláris tömege a gáz; - az univerzális gázállandó.
Ideális gáz állapotegyenlet is a kifejezést:
ahol n - a gáz koncentrációja az molekulák e kötet; .
A alapegyenletének molekuláris kinetikai elmélet
Ezt a modellt használva, mint egy ideális gáz, az alapvető egyenletet kapjuk a molekuláris kinetikai elmélet (ICB) (3). Ami azt jelzi, hogy a gáz nyomása az eredménye hatalmas löketszám molekulája az edény falához, ahol a gáz.
ahol - az átlagos kinetikus energiája transzlációs mozgása gázmolekulák; - a gáz koncentrációja az molekulák (N - száma gázmolekulák a tartályban; V - az a térfogat a hajó); - a tömege gázmolekulák; - effektív sebessége a molekula.
A belső energia az ideális gáz
Mivel az ideális gáz fogadására potenciális energiája közötti kölcsönhatás molekulák nullával egyenlő, a belső energia összegével egyenlő a mozgási energia a molekulák:
ahol i - száma szabadsági fok a molekulák egy ideális gáz; - Avogadro-szám; - anyagmennyiség. A belső energia az ideális gáz határozza meg a termodinamikai hőmérséklet (T), és arányos a tömeg.
A munka egy ideális gáz
Egy ideális gáz az izobár () munka számítását a következő képlet:
Működés izochor folyamat gáz nulla, mivel nincs térfogatváltozás:
Izotermikus folyamat ():
Az adiabatikus folyamat () művelet:
ahol i - száma szabadsági fok a gázmolekulák.
Példák problémák megoldására vonatkozó „Ideális gáz”
Mi a az elegy sűrűségét ideális gázok T hőmérsékleten és nyomáson p, ha a tömeg a gáz és moláris tömeg, moláris tömege a második gáz tömege?
A meghatározás szerint homogén anyag sűrűsége () jelentése:
ahol m - tömege a teljes anyag; V - a térfogata. Mass gáz keveréke az összege az egyes komponensek keverékéből:
Továbbra is, hogy megtalálják a mennyiség, amely azon a gázok keveréke előre meghatározott körülmények. Ehhez írunk az egyenlet Mengyelejev - Clapeyron a keverékre:
ahol a mennyisége az anyagkeverék () találtam:
Express a keverék térfogatát, használva (1.4):
Mi helyettesíti (1.2) és (1.5) a (1.1), kapjuk:
Itt következő eljárások, amely eljárás egy ideális gáz megfelel a grafikon az 1. ábrán látható? Izochor, izobár, adiabatikus.
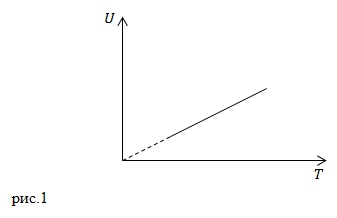
A belső energia az ideális gáz kerül meghatározásra:
Ez arányos bármelyik folyamat hőmérséklete. Egy tömegállandóságig azonos gáz a izochor, izobár és adiabatikus folyamatok, megkapjuk a grafikon az 1. ábrán látható