A katalizátorok hatására a reakció sebessége
Katalizator- egy anyag nem fogy el a reakció, de befolyásolja a sebességet.
A jelenséget a változása a reakció sebessége az intézkedés alapján az ilyen anyagok úgynevezett katalízis. Jellemzően, katalizátorok olyan anyagok, amelyek növelik a reakció sebességét, és inhibitorok - anyagok, amelyek késleltetik a reakciót. A legtöbb esetben a katalizátor hatás magyarázható az a tény, hogy csökkenti az aktiválási energia a reakciót.
A sok kémiai reakciók izoláljuk visszafordíthatatlan és reverzibilis reakciók.
A reakciókat, amelyek előfordulnak csak az egyik irányba, és végét egy teljes átalakulást a kiindulási anyagok a végső termékeket nevezzük visszafordíthatatlan.
Az a feltétel, kémiai reakció visszafordíthatatlan: kicsapás, gázfejlődés, a formáció malodissotsiiruemogo anyagok elosztását és nagy mennyiségű energia. Az egyenletek irreverzibilis reakciók között a bal és a jobb oldal egyenlővé vagy nyíl.
Ezek az úgynevezett reverzibilis reakciók, amelyek egyidejűleg megy végbe két kölcsönösen ellentétes irányokban.
A egyenletei reverzibilis reakciók fel két nyíl ellentétes irányba.
Váltvaforgató reakciók nem éri el a végét, és megszünteti a létesítmény kémiai egyensúly. Kémiai egyensúlyok lehet meghatározni, mint a rendszer állapotáról a reagensek, ahol a forward és reverz reakció sebessége egyenlő egymással (# 965; pr = # 965; arr).
Egyensúlyban az előre és hátra reakciók nem alakítható úgy, hogy egyensúlyt az úgynevezett mobil és dinamikus egyensúly.
A reaktánsok koncentrációja, amelyek telepített egy kémiai egyensúlyban, az úgynevezett egyensúlyi.
Kémiai egyensúlyok jellemzi az egyensúlyi állandó (Kp) - az arány a sebességi állandói az előre és hátra. Például, a homogén rendszer CO (g) + H2O (g) ↔ CO 2 (g) + H2 (g), az egyensúlyi állandó van írva a következő:
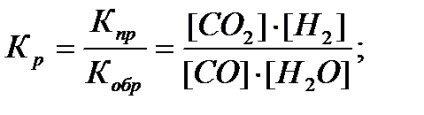
A biztosított egy matematikai kifejezést az úgynevezett tömeghatás törvénye a reverzibilis kémiai reakció.
Napfény reakciórendszer egyik egyensúlyi állapotból a másikba az úgynevezett kiszorításos (vagy eltolt) a kémiai egyensúly. A műszak kémiai egyensúlyi koncentrációjának befolyásolja a reagensek, a hőmérséklet és a gáz-halmazállapotú anyagok - és a nyomás. kémiai egyensúly elmozdulási irányában hatása alatt ezeket a tényezőket határozza meg az általános helyzetben, ismert, mint az elve dinamikus egyensúly vagy -Brauna Le Chatelier-elv: Ha a rendszer egyensúlyban van, ami készült-vagy külső hatás, kedvező, hogy az áramlás a reakció, amely gyengíti a hatását .
Le Chatelier-elv - például a Braun reakcióban hidrogén-klorid oxigénnel
1) A megnövekedett koncentrációi reaktánsok tolódik az egyensúly felé áramlását ezen anyagok, azaz a jobbra. Koncentrációjának csökkentése a reagensek - az irányt kialakulásuk, azaz maradt.
2) Mivel a közvetlen reakció exoterm, a hőmérséklet emelkedése elősegíti az áramlás a hőmérséklet az abszorpciós folyamat, azaz, Az egyensúly eltolódik balra. Az abszorpciós hőmérséklet tolódik az egyensúly mellett a közvetlen reakció.
3) a nyomás hatása az egyensúlyi csak akkor lehetséges, gáz-halmazállapotú rendszerek, fogja megváltoztatni a móljainak száma a gáz-halmazállapotú anyagok. Növekvő nyomás eredményez elmozdulását az egyensúlyi felé reakció, ami egy kisebb mennyiségű anyag, azaz jobbra. A nyomás csökkentésével - a bal oldalon.
Katalizátorok nem befolyásolják a kémiai eltolódás egyensúly a rendszerben, mivel a egyformán változtatja a sebességet előre és visszafelé reakciókat.
Kérdések az önuralmat
1. Mi az úgynevezett kémiai reakciók sebességének a homogén és heterogén rendszerben. A dimenziója a kémiai reakció sebessége.
2. Határozza meg az alaptörvényt a kémiai kinetika - a tömeghatás törvénye.
3. Milyen tényezők befolyásolják a vegyi reakciók arányát? Mi a különbség a kinetikai homogén és heterogén kémiai reakciók?
4. Mi az aktiválási energia a reakció?
5. Mi a különbség a reverzibilis és irreverzibilis kémiai reakciók?
6. Az úgynevezett állapotban a kémiai egyensúly és miért hívják dinamikus?
7. A szabály megfogalmazott Chatelier - Brown?
8. Hogyan katalizátorok a kémiai egyensúly a rendszer?
9. Melyek az alapvető fogalmak elmélet aktív ütközés?
10. Milyen tényezők befolyásolják a kémiai egyensúly?