A hősokk fehérjék (HSP-k)
A hősokk fehérjék (HSP-k). A hatások a veleszületett immunválaszt HSPk
A hősokk fehérjék (hő Shok fehérjék HSP) széles körben elterjedtek a természetben, és az egyik legjobban konzerválódott molekulák közé bioszférában. Az elsődleges funkciója a HSP-k - Védelem a biológiai rendszerek a káros stressz hatásait. Az evolúció eukarióták néhány HSP-k szerezték jellemzői, amelyek lehetővé tették, hogy integrálódjanak a rendszerbe az immunitás.
A szerepe a HSP-k a interakciós mechanizmusokat a veleszületett és szerzett immunitás függ a képesség, hogy elfogják HSP és antigén peptidek képviselje őket használatával DC T-limfociták a MHC-molekulákkal összefüggésben.
Hősokkfehérjék fontos életfunkcióit és bemutatott minden élő szervezetben. géntermékek, hogy neve hősokk fehérjék vagy celluláris stressz termelt fehérjék egy hipertermia, eredetileg azonosított molekulák válaszul a jelenlétét a sejtekben a nem megfelelően feltekeredett fehérjék. Aztán kiderült, hogy a HSP szerepét chaperonok nem-kovalens össze- és szétszerelése más makromolekuláris szerkezetek, amelyek azonban nem állandó elemei ezek a szerkezetek a feladataik biológiai funkcióit.
Reakció hősokk fehérjék nem rögzített csak feltételeinek hipertermia, hanem az oxidatív stressz alatt, acidózis, ischaemia, hipoxia, hiperoxia, az energia kimerülése sejtek és T n. Ilyen körülmények között, a HSP-k szabadulnak fel nekrotikus sejtek szövettenyészetben megsemmisítése vagy lízis a fertőzött sejteket.
Due különösen elismerése hidrofób aminosav-szekvenciák a felszínen fehérjék, mint egy figyelmeztető jel konformációs instabilitásuk, a HSP-k képesek megvalósítani ilyen életfunkciók részeként biztosításában térbeli szerveződésének a fehérje molekulák (összecsukható körülmények között), a stabilizáció, korrekciója konformációs változások (refolding) transzlokáció fehérjék membránokon keresztül intracelluláris organellumok, megelőzésére fehérjedegradáció és aggregációja instabil fehérjék. Ugyanakkor, a HSP mutatnak anti-apoptotikus aktivitást. Összességében, a HSP-k jár, mint egy puffer-rendszer, számláló sztochasztikus és potenciálisan destabilizáló tényezők a celluláris környezetet.
HSP-k fontos szerepet játszanak az immunválasz kiváltásának, különösen a veleszületett immunrendszer: aktivitásának növelése NK-sejtek, APC érés és citokin termelését. A peptidfragmenseket fehérjemolekulák hasadó elfogott HSP-k, és végül a feldolgozás alatt a APC által kiváltott, az adaptív immunitás. Így, aktiválása révén APC és az antigén részt vesz a feldolgozás hősokkfehérjék integrálni reakciók veleszületett és szerzett (adaptív) immunitás.
Immunstimuláló tulajdonságokkal mutatnak HSP pro- és eukariticheskogo eredetű. Az a képesség, hogy immunválaszt indukál van képviselők több család a HSP (calreticulin, HSP10, HSP60, HSP70, HSP90, HSP100 és HSP170).
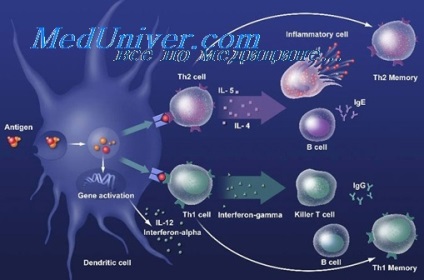
Chaperon funkciójának hősokkfehérjék végezzük nemcsak biogenezisében más fehérjék, hanem a immunválasz antigének. Környezeti változás fertőzése teremt stressz helyzetet a behatoló kórokozó, vagy olyan gazdasejt, amely abban nyilvánul meg, kölcsönös intenzívebbé szintézise és funkcionális aktivitását hősokkfehérjék. Molekuláris chaperonok baktériumok ligandumként szolgálnak receptorok felszínén gazdasejtekben.
HSP-k által elismert TLR2, TLR4. Egyéb dr96, HSP90 és HSP70, kölcsönhatásba antigénbemutató sejtek egy közös receptor, CD91. HSP-chaperon peptidek behatolnak makrofág / dendrites sejtek révén CD91, a feldolgozott és együtt jelennek MHC I és MHC II. Ez okozza a CD4 és CD8 T-sejtek. HSP-DC keresztül CD91 kölcsönhatás éréséhez vezet, dendritikus sejtek és a citokinek.
A kölcsönhatás a rekombináns M tuberculosis HSP 70 ki a TLR-2 és TLR-4 in vitro kiváltott jelátviteli kaszkád bevonásával az adapter fehérjék MyD88, TIRAP, TRIF és villamos humán endothelialis sejtek és a makrofágok egereknél egy aktiváló faktor NF-kV-os transzkripciós.
Bevezetett az endoplazmatikus retikulumban eukarióta chaperon GRP94 / gp96 kölcsönhatás révén TLR-2 és TLR-4 aktiválja a dendritikus sejteket, hogy kezdeményezzen CD8 „T-limfocita-választ. Így fokozott expressziója MICA / B kölcsönhatásba lépő molekulákat NKG2D receptor bemutatott felszínén CD8, de nem a CD4 * T-sejtek. A kölcsönhatás a HSP70 a TLR7, aktívan szekretálódik, és szabadul fel, amikor a nekrotikus halálát emlős sejtek fokozott fagocita funkcióját a makrofágok. Ez a hatás látható néhány percig, és van kifejezve nem csak a stimuláció a fagocitózis, hanem a funkciója antigén prezentáció a T-sejteknek keresztül jelátviteli utak által közvetített foszfoinozitid-3-kináz és a p38 MAP-kináz.
Egy megvalósítási mód szerint az antigén prezentációt a T-helper sejtek is részt érett B-limfociták expresszáló TLR-2 és TLR-4. Úgy reagálnak LPS, peptidoglikán, HSP60 fokozott MHC II és ko-stimulátor molekulák. Emberi HSP 60, de nem GroEL E. coli vagy HSP65 M. tuberculosis által indukált proliferációját a naiv egerek B-sejteket és az IL-6 és IL-10.
Ma sok receptorokhoz. felismerve minták ismert ligandummal prokarióták, gombák, vírusok, protozoák kórokozók még nem jellemzi. Van egy kapcsolat a fagocitózis és kifejezése TLR-ek, mivel az aktivációs jeleket TLR fokozza fagocita folyamatok és modulálja fagocitózis aktivációs szekvenciát TLR.
Nyilvánvaló, hogy még nem definiált molekuláris mintázatok torzíthatja vagy közvetlenül az adaptív immunválasz a Th-2 típusú lehet, hogy a hiánya jelek (például a - PAMP), mint azok az MHC I-hiány NK-sejt aktiváció arra ösztönzi, hogy futtatni a második típusú immunitást.
A indukciója jelző révén Toll-szerű receptorok nemcsak védelmet a szervezet különféle fertőzések elleni. Megsértése vezetési szerepe adatjel kifejlődéséhez vezetnek számos kóros folyamatok a szervezetben. Például, a túlzott gyulladást keltő citokinek termelődését endogén ligandumok okozhatja a krónikus gyulladás, autoimmun betegségek, mint a Crohn-betegség, 1-es típusú cukorbetegség, ateroszklerózis. Megváltoztatása egyensúlyt a proinflammatorikus citokinek, valószínűleg a fejlesztéshez a helyi ödéma és gyulladásos reakciók a CNS által kezdeményezett gyulladáskeltő citokinek (TNF-a vagy IL-1p). A formáció a hosszú távú neurológiai rendellenességek, amelyek több citokinek potencirozására termelődését és egymástól tárolja a hosszú keringési.
A folyamatos jelenléte citokinek támogatja krónikus gyulladás a központi idegrendszer, kíséretében demielinizáció, és bizonyos esetekben, és az idegsejtek halálához.