A hőbomlás ammónium-nitrát és a tűz - és robbanásveszélyes
Hosszú tapasztalat termelés és az ammónium se literes kimutatta, hogy tiszteletben tartva a szabályokat állapított ammiach Nye nitrát biztonságos 57
66. Pure ammónium-nitrát-nek nincs érzékenység rázkódás, ütés vagy súrlódás. Azonban, bizonyos körülmények között, ammónium-nitrát robbanásveszélyes tulajdonságok. Ezen az alapon, és használják nyersanyagként a termelés ammi - achno-Selitrennoe robbanóanyagot. Úgy fújja csak a detonátort. Robbanások tiszta ammónium-nitrát lehet you-címeket a fő vagy hatás detonátor vagy a termikus bomlása során a sót egy zárt térben.
Növeli a robbanékony ammónium-nitrát jelenlétében ásványi savak L könnyen oxidálható anyagok, például a szerves anyagok és bizonyos fémek, különösen a por alakú állapotban (például, alumínium, cink, ólom, antimon, bizmut, nikkel, réz, kadmium). A legtöbb esetben jelenlétében-ményeit ezen fémek (különösen a kadmium és a réz) kialakítva Unst-hajszol könnyen bomló ammónium-nitrit.
A növekvő részecskeméret és a páratartalom további növelésével-robbanás voopasnost ammóniumnitrát jelentősen csökken. Nedvesség Nye só, amely több mint 3 tömeg% vizet, nem robban, akkor is, ha a robbanás a detonátor 58'5E.
A fűtés az ammónium-nitrát bomlani kezd a következő egyenlet szerint:
Ez a bomlás jelentőssé válik a fenti 150 °, de még 165 °, a súlyvesztesége ammónium-nitrát nem haladja meg a 6% naponta. Magasabb hőmérsékleteken az ammónium-nitrát bomlik intenzíven in-67 a következő reakciókkal: AT 200-270 '
(Melegszik ezek a reakciók a 18 ° és a gáz halmazállapotú reakciótermékeket.) Az utolsó egyenlet felel meg robbanásszerű bomlás NH4N03. Hőbomlás NH4N03 pro-come egyidejűleg több reakciók, melyek közül az egyik uralja a többivel. Termikus bomlás salétromsav okozza a megjelenése egy gáznemű terméket a bomlás az ammónium-nitrát és N0 NO2. Úgy tűnik, a kiosztani-schiesya hőbontásával salétromsav és H20 N02 katalizálják a bomlás további NH4NO368. Termikus bomlás az olvadt ammóniumnitrát ryaetsya expressz bejelentkezési jelenlétében vegyületek SG6 +, Cr3 +, Cr2 +, és mások. 69. Az egyirányú Kim, tiszta ammónium-nitrát bizonyára carry-on, hogy egy osztály a potenciálisan robbanásveszélyes anyagok.
Az ammónium-nitrát, amely tárolja a nyitott raktárak, nem fúj Xia még abban az esetben súlyos tüzet. Tüzek ammónium Celite-ry, hogy történt zárt terekben, például a CO-rabelnyh tartja, konténerek, és így tovább. N. záruló általában erős robbanás. Úgy tartják, hogy a termikus bomlása ammónium no-hulladékok, atmoszferikus nyomáson történik másként, mint magasabb nyomáson, amelynél a bomlási sebessége mo-Jette lennie gyorsabban és nagy mennyiségű gáz-halmazállapotú különböző termékek. 64 kimutatták, hogy létezik egy „korlát” nyomáson (körülbelül 6 atm), amely után az alul-ill jön a hőmérsékleten robbanásveszélyes bomlás ammónium-nitrát.
Másrészt, a könnyű éghetőségi és robbanékony ammónium-nitrátot, hogy nem szellőztetett zárt, nem lehet megmagyarázni a növekedés a teljes nyomás, ami a másodlagos ok, és a felhalmozási termékek mézes lennogo nitrát bomlik. Spontán bomlása am miachnoy nitrát jelenlétében oxidálható, például szerves anyagok avtokatalitichesknm. Az ilyen bomlási feszültség okozhat a tűz és robbanás. Te-autokatalízis nevezhető úgynevezett elsősorban által alkotott bomlása nitrogén NH4N03-dioxid is, de kisebb mértékben, a vízgőz. Az utóbbi körülmény arra utal elfogadhatatlanságtól Sun tűzoltó láng nitrát gőzt.
Stabilizátorok, amelyek megakadályozzák a spontán bomlása az ammónium-nitrát-feszültség lehet kötőanyagok során képződött a bomlási salétromsavat, és NO2, vagy ha-hasadó NH4N03 ammóniával reagáltatva. Az utolsó, ez központosítja salétromsav és helyreállítja a nitrogén-oxidok elemi nitrogént. Stabilizátorok, például a szénhidrát-amidot (0,05-0,1 tömeg% ammónium-nitrát), 70-73 kalcium-karbonát vagy mage-TION (5%), kloridok, és a metén-amin dr.67.
TOC o "1-3" H z A ammónium-nitrát. 1
ammónium-szulfát. 1.3
kalcium-nitrát. 1.5
Az ammónium-nitrát potenciállal rendelkezik (fiziológiás) savasság. Fiziológiailag semlegesítjük ammónium SE-literes történö fúziójával készíthetjük, hogy mészkő, dolomit és Dru-gimi materialami76. Robbanás csomósodás ammóniumnitrát visszatartotta a termelés a tőkés országokban. Csak a háború utáni időszakban, amely a sikeres tapasztalatokat a Szovjetunió, először az Egyesült Államokban, majd más országokban is, a használata ammiach távú nitrát nitrogén műtrágya volt széles körben időben vitie.
Az ammónium-nitrát gyártásához használt robbanóanyagok - ammoniteszek (ammóniumnitrát szerves anyagok - fa, olajpogácsa és egyéb lisztet azzal a kiegészítéssel, nn - troproduktov)., Ammonalov (tartalmazó keverékek alumínium roshok), stb Ezekre a célokra, termelnek vízálló CE 77 liter
Összetétele ammóniumnitrát táblázatban látható. 89.
Ammónium-nitrát összetétel (%)
Ha a csomagolás salétrom hőmérséklet nem lehet magasabb, mint 50 ° C.
Ez tele van papírzsákban bitumen (három ----------------
Pyatnsloynye), valamint a műanyag meshki80. Az ammónium-nitrát B osztályú, a mezőgazdaságban használt ipari-ség legyen porhanyós. A törési szilárdság határozza meg egy csepp minden öt zsák-nitrát a padlón egy magassága 1 m, majd átszitáljuk egy szitán 5 mm.
Során szitálással nitrát kell teljesen rostán átmennek; engedélyezve szitamaradékot egyéni dudor-Mykh könnyen zúzott kézzel.
Nyersanyagok és termelési módszerek
Az ammónium-nitrát, azzal jellemezve, semlegesítő salétromsavat gázzal ammiakom81-84 és a termék kristályosítására. Ammónia nem tartalmazhat több, mint 1% nedvességet; ez nem megengedett az olaj jelenléte.
A semlegesítési hő knal / g-mol NH ^ sz
Ábra. 341. A semlegesítési hő képződését salétromsav gáznemű am MIAK (1 atm n 18 °).
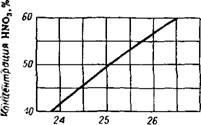
A salétromsav koncentrációja tovább tart, mint 45% HN0385; Készletező nitrogén-oxidok nem haladhatja meg a 0,1% -ot is. Egy sugárzás-ammónium-nitrát mo-bél is használható on-gyártás- mozog ammóniás például vizes ammóniát, és a tartály és leürítő gázok vezetett-ki tároló folyékony ammóniát és előállított pro-duvkah ammónia szintézis rendszerek. A készítmény gáztartály: 27 45-70% NH3, 55-30% H2 + N2 (nyomnyi -
Ni metán és argon); pro-szerkezet duvochnyh gázok: 7,5-9% NH3, 92,5-91% H2 + N2 (nyomokban metán és argon). s
Továbbá, az ammónium-nitrát, továbbá használt gázok desztillációs karbamid; azok hozzávetőleges összetétele: 55-57% NH3, C02: 18-24%, 15-20% H20 86.
A termikus hatása NH3 (r.) + NK03 reakció (g.) -> NH4N03 stavlyaet CO-35.46 kcal / g-mol. A termelés az ammónium-nitrát általában használt 45-58% -ing savat. Ebben az esetben, a termikus hatás semlegesítési reakciókat ennek megfelelően csökkenteni a hőmennyiség a salétromsav vízzel hígítva, és a hőmennyiség oldódási ammónium-nitrát (ábra. 341). Ha Ra-nyos felhasználási fejlődött a semlegesítési hő állíthatjuk elő a víz párolgása koncentrált versenyek létrehozza és még olvadék ammónium-nitrát (ábra. 342) 87.
Ennek megfelelően különbséget áramkör oldat előállítása ammónium-nitrát, majd bepárlással rá (az úgynevezett multi-Vai folyamat), és így egy olvadék (odnosta-diyny vagy bezuparochny folyamat).
Válasszon ki egy racionális rendszer semlegesítése Szovjetunió vizsgáltunk négy alapvetően eltérő sémák ammiach-sósav nitrát-TEP la neytralizatsii88 „101:
növények atmoszféra nyomáson működő (gauge nyomású gőz juice 0,2at 0,15);
Illesztése egy vákuum-elpárologni Lemma;
szerelési munka, nyomás alatt, egy-ispol'uet mations hő juice gőzt;
szerelési munka, nyomás alatt, egy dupla-vaniem használ gőzfűtés lé (koncentráljuk luchenie olvadék).
Az ipari gyakorlatban a folyamatos széles alkalmazási mint hatékonyabb Nai-szerelési lépések olvadáspontú atmoszférikus nyomáson, a hő-tralization és szerelése részlegesen vákuumbepárló.
Olymódon, hogy nátrium-klorit és klór történik Obra mations-klorid, nátrium-és a klór-dioxid szabadul fel: 2NaC102 + C12 = 2NaCl + 2 SYU2 Ezt a módszert korábban megszerezni az alap-dioxid ...
Ábra. 404 termelését mutatja rendszer diammonitro - Fosco (típus TVA). A foszforsav koncentrációja 40-42,5% P2O5 kollektor 1 2 szivattyú szállított 3 felfutószekrény Koto-cerned folyamatosan ...
Fizikai-kémiai tulajdonságok ammónium-szulfátot (NH 4) 2S04 - színtelen kristályok rombiche XYZ alakú sűrűségű 1,769 g / cm3. Műszaki-szulfát lőszer-CIÓ egy szürkés-sárgás árnyalat. A fűtés az ammónium-szulfát bomlik a veszteség az ammónia a fejlődő ...