A hibridizációt az elektron felhők
4. Be. 2s 2 → Be *. 2s 1 2p 1
Miután két páratlan elektronnal, berillium atom kialakítására képes két kapcsolatot, hogy a csere mechanizmus.
A kapott kapcsolatot kell lennie különböző az energia, mint az elektronok különböző sublevels. Azonban kísérletileg bebizonyította, hogy a két teljesen egyforma kapcsolatot. Következésképpen, a formáció a kémiai kötések egy illesztése az atomi pályák az energia és a forma. Ezt a folyamatot nevezik - hibridizáció. és a „igazított” pályák nevezzük hibrid.
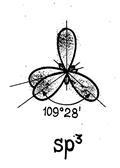
hibridizáló egyikének esetében az S- és p- pályák nevezett egy SP-hibridizáció.
SP-hibridizáció tipikus lineáris molekula szerkezete, vegyérték szög 180 ° .tak néző hibridizáció megfigyelhető a csoport II elemeket.
Például: BeCl2 esetében berillium-klorid molekula - berillium atom, hogy kötést képezzen két klóratom helyettesít olyan gerjesztett állapotban (a fentiek szerint). Ennek eredményeként, az elektron felhők s - (szférikus valószínűséget), és egy p-elektron (amelynek nyolc esélye térfogatú) mennek keresztül sp hibridizáció, ami a két hibrid felhő képződik, amely található a térben 180 0:
Minden egyes A két klóratom hibridizáció nem fordul elő, mivel szükség van egy párosítatlan elektront (mivel az elektron található a p-alréteg, az alakja az elektron felhő - térfogat nyolc) kialakítására kapcsolatot berillium:
Így a rendelet alapvető elmélete hibridizáció:
1. A hibridizációs pályák részt különböző sublevels az ugyanazon a szinten.
2. Az száma hibrid pályák egyenlő számú tiszta orbitálok részt hibridizációs.
3. A hibrid pályák több hosszúkás irányába kialakított kémiai kötéseket tartalmaz és így egy jobb átfedés elektron felhők.
Oldal keletkezett: 0,008 sec.