A főbb rendelkezések a módszer vegyértékkötéseket
1. kovalens kémiai kötések által képzett két elektron ellentétes forog tartozó két atom. Például, azt a megközelítést, két hidrogénatom részleges átfedés elektron pályák, és alkot egy közös elektronpárt
A kovalens kötés kialakulhat egy donor-akceptor mechanizmus. A képződésének mechanizmusát a kovalens kötés miatt elektronpárt az egyik atom (donor) és egy másik atom (akceptor), amely erre a két szabad orbitális úgynevezett donor-akceptor.
Tekintsük példaként a mechanizmus képződési ammóniumion, NH4 +. A molekula van osztva NH3 három elektronpár alkotnak három kommunikációs N-H, a negyedik pár külső osztatlan elektronok, ez adhat egy kötés a hidrogén-ion, az eredmény egy ammóniumion, NH4 +:
Így a NH4 + ion négy kovalens kötések, mind a négy kötés N-H egyenértékű, azaz, az elektronsűrűség egyenletesen oszlik meg közöttük.
2. A kovalens kémiai kötés fordul elő átfedő hullám funkcióit elektronok (elektron pályák), és a kapcsolat lesz a erősebb, annál ez az átlapolás.
3. A kovalens kémiai kötés van az irányba, amelyben a lehetőségét átfedés a hullám funkciók az elektronok alkotó kommunikáció lesz a legnagyobb.
4. A vegyértéke a tartalmaz a normális (nem gerjesztett) állapotban határozzuk meg:
- számú párosítatlan elektront résztvevő kialakulását megosztott elektron párok az elektronokkal más atomok;
- jelenlétében donor képessége (rovására egy osztatlan elektronpárt).
A gerjesztett állapot határozza meg a vegyértéke az atom:
- számú párosítatlan elektront;
- több betöltetlen pályák fogadására képes egy elektronpárt donor.
Így vegyérték kis egész számok kifejezett, és nincs jele. Mérjük az a szám, vegyérték kémiai kötéseket. hogy az atom van csatlakoztatva a másik.
A vegyérték elektronok elsősorban külső szinten, de al-csoportok elemek és elektronokat tartalmaznak, és utolsó előtti (predvneshnih) szinteket.
Tekintsük az elektronikus konfiguráció a bóratom:
ahol B * - bóratomot gerjesztett állapotban.
Bóratomot alapállapotú egy vegyértékű. bóratom a gerjesztett állapotban három párosítatlan elektront, és képezhet vegyületet, ahol majd trohvalenten. A fordított energia az átmenet egy atom a gerjesztett állapotból az azonos energia szinten, általában több mint ellensúlyozta a felszabaduló energia a formáció további kötések.
Jelenléte miatt a szabad bóratomot pályák Forest - az egyik legerősebb akceptorok nem megosztott elektronpár. Például:
Az eredmény egy komplex ion [BF4] -. amelynek négy kovalens s -bond.
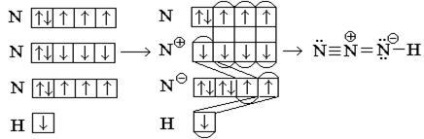
Ábrázoljuk az elektron eloszlása diagramja nitrogénatom:
Mivel a nitrogén három páratlan elektronja, vegyértékével három. Átmenet a nitrogénatom a gerjesztett állapotban nem lehetséges, mivel a második réteg nem tartalmaz energiát d-pályák. A nitrogénatom nyújthatna osztatlan elektron pár külső elektronok atom, amelynek szabad orbitális (akceptor). Például az ammónium-ion a nitrogén tetravalens (ld. 1.).
Reakcióvázlatok átfedés atomi pályák kialakulását kötvények a molekulák H2 O, NH3. CH4
Egy vízmolekula áll, egy oxigénatomot és két hidrogénatom. Két p-párosítatlan elektront az oxigén atomok foglalnak két orbitális, amelyek úgy vannak elrendezve a 90 o egymással. A formáció a molekulák a víz minden egyes p-orbitális elektron orbitális átfedés s - elektron a hidrogénatom (7.1 ábra.).
A szög közötti kötések közel kell lennie a szög közötti p-elektron felhők, azaz 90. Megállapította kísérletileg, hogy a szög közötti kötések egy molekula víz egyenlő 104,5. Ez annak a ténynek köszönhető, hogy az elektronok erősebben hívni a oxigénatom, mert az O-H kötés poláros kovalens kötés. Így van taszítás pozitív töltések származó hidrogénatomok, amelyek növekedéséhez vezet a szög közötti kötések.
A formáció ammónia molekulák magában foglalja a három p-párosítatlan elektront a nitrogénatommal, pályák amely található három egymásra merőleges irányban, és a három s-elektronok a hidrogénatomok (ábra. 7.2).
Három N-H kötések az ammóniát molekulát kell szögben helyezhetők el egymáshoz, közel 90 °. Megállapította kísérletileg, hogy a szög közötti kötések az ammónia molekula körülbelül 107,3. ennek oka, hogy ugyanezen okból, mint abban az esetben, a vízmolekula. Ezen túlmenően, nem tartjuk része 2s-elektronok a kialakulását a kémiai kötések.
A formáció a metán szénatom molekula válik izgatott, azaz három p-párosítatlan elektront, és egy s-elektron.
Reasoning ugyanolyan módon, mint a korábbi esetekben, akkor feltételezhető, hogy a szénatom képez három kommunikációs szög alatt 90 o egymással és a kommunikáció célja önkényesen, mivel van kialakítva s-elektron, és s-elektron gömbszimmetrikus.
Mivel a p-pályák a több, hosszúkás magot, s-orbitális átfedés a erősebb általuk pályák más atomokat, és ezért, kötések által alkotott p-elektronok kell erőteljesebb. De ez ismert a kísérlet, hogy a csatlakozások a metán molekula és a egyenértékű irányítja a csúcsok egy tetraéder (a szög közötti kötések mintegy 109,5.
Ez a jelenség azzal magyarázható, fogalma hibridizáció a hullám funkciók által bevezetett Pauling és Slater. A hibridizáció a vegyérték pályák - ez az összehangolás az alakjuk és az energia. A fogalom a hibridizációs használjuk abban az esetben, ahol a a kötés képzésében a molekulában érintett elektronok tartozó különböző típusú pályák. Aszimmetrikus hibrid orbitális, és erősen húzzuk, hogy egyik oldalán a mag.
Tekintsük az elektronikus szerkezet a metán molekula, hanem abból a szempontból az a hibridizációs módszerrel. Négy párosítatlan elektront szénatomok kölcsönhatásba egymással képződése során egy kémiai kötés egy másik atommal elektronok, így négy új hibrid ekvivalens felhő. Ezt hibridizációs nevezik sp3 hibridizációs. Négy teljesen azonos -Hybrid pályák sp3 szénatomhoz szögben mintegy 109,5 egymással, és arra irányul, hogy a csúcsai a tetraéder, amelynek a középpontja a szénatom (ábra. 7.3).
Ez felveti azt a kérdést - ez lehet pozícionálni a hibridizációs pályák megmagyarázni a kialakított kémiai kötésen atomok közötti molekulák H2 O és NH3. Orientációja kötvények ezek a molekulák is magyarázható fogalmát használva hibridizációs. Ez a megközelítés még pontosabb, mint a korábban felvázolt. Ez azért van, mert a hibrid orbitális erősen megnyúlik az egyik irányba a mag és hibrid pályák átfedés más elektronikus pályák atomok több hatásosabb, mint az átfedés a pályák S- és p elektronok, ami a kialakulása egy erős kötést, és így, és több stabil molekulákat.
Mielőtt rátérnénk a molekuláris struktúráját H2 O és NH3 felhasználásával a hibridizációs modellt képeznek az algoritmus meghatározására a geometria a molekula ezzel a módszerrel:
- meghatározásához szükséges jelenlétének vagy páratlan elektron pár párosítatlan elektront a központi atomok (a pozícióját a periódusos rendszerben);
- kell találni számos hibrid pályák az összegével egyenlő s és -kötéseken az osztatlan elektron pár a központi atom;
- be kell állítania a fajta hibridizáció pályák:
Más típusú hibridizációs elektron hullám funkciók, például, hibridizációs bevonásával d-pályák.
kémiai kötés kialakulását a molekulák H2 O és NH3 is magyarázható a helyzetét sp3 hibridizációs atomi pályák az oxigén és a nitrogén (ábra. 7.4).
Míg a szénatom négy hibrid pályák foglalt kötési elektronpár (. 7.3 ábra), a nitrogénatom egyike a négy hibrid pályák elfoglalt osztatlan elektronpárt (szög 107,3), és az oxigénatom - két orbitális (szög 104,5 o) (ábra. 7.4). Ennélfogva, a taszító akció osztatlan elektronpár befolyásolja kötésszöget - az átmenet a metán molekulák molekulák víz és ammónia vegyérték szög csökken.
-Kommunikáció - a kémiai kötés eredményeként képződött az átfedés az elektron pályák összekötő egyenes mentén a magok az atomok.
-Kommunikáció - a kémiai kötés eredményeként képződött az átfedés az elektron pályák mindkét oldalán összekötő vonal az atommagba.
vegyértékei rendszerek overlay módszer. delokalizált-kötés
Tekintsük az overlay eljárás vegyérték rendszerek példa azidovodoroda HN3. HN3 a molekulában nitrogénatomok kapcsolódnak egymáshoz, és a csatlakoztatott hidrogénnel egy.
A központi nitrogénatom lehet három vegyértékű miatt párosítatlan elektront, de mindkét esetben továbbra is a molekulában két párosítatlan elektront, így nem valószínű áramkört.
Mi át a egyik s-elektron központi atom a „felső” nitrogénatom:
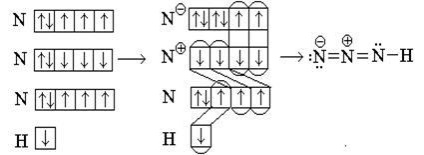
Equiprobable diagram kapunk, ha mozog az egyik s-elektronok egy másik atom a középső nitrogén atom: