A Mayer-egyenlet a fizikában
Ebben az egyszerű egyenletben a mennyiség fizikai lényege van, az univerzális gázegyenlet 8,31 J / (mol • K) értékkel egyenlő.
Ebben a cp a mól hőteljesítmény állandó nyomáson. és cv, állandó térfogatú körülmények között.
A moláris hőkapacitás azt jelzi, hogy a Joule-ban mennyi hőmennyiséget kell alkalmazni egy mól gázra, hogy 1 Kelvin hővel hűtse. Az izokorikus folyamat moláris hőteljesítményét a következő képlet határozza meg:
Gyakorlati számításoknál gyakran alkalmazzák a fajlagos tömeghő kapacitást, és általában a termofizikai mennyiségi táblázatokban adják meg. A gáz moláris hõkapacitásának móltömegével való szorzása révén megkapjuk a fajlagos tömeg hõkapacitását:
Miért kellett általában megkülönböztetni az izohóri és az izobár hőt?
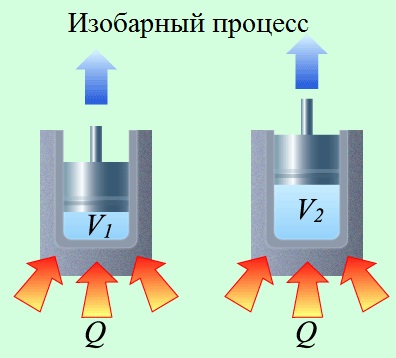
Az izobár folyamatban (állandó nyomáson végzett eljárás) a termodinamika első törvényét az alábbi képlet jellemzi:
ahol - a gázhoz mellékelt hő mennyisége - a gáz belső energiaváltozása, - a gáz kitermelési munkája.
És ez azt jelenti, hogy az izobár folyamatban lévő gáz hője a belső energia megváltoztatására és a kibővítésre törekszik.
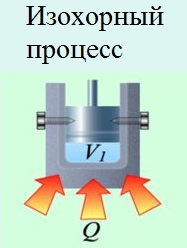
Ha a gázt zárt térben lezárják (izokorikus folyamat), akkor a bõvítéssel kapcsolatos munkát nem fogják elvégezni (), és a rendelkezésre bocsátott teljes hõt a belsõ energia megváltoztatására fordítják:
Ha levonjuk a másodikat az első kifejezésbõl, akkor:
Így az R gázkoncentrátum határozza meg az 1 mól gáz kibővítésével járó munkát, amikor 1 Kelvin állandó nyomáson melegíti.
Példák a problémamegoldásra
A szén-dioxid mólos izochorikus hőteljesítménye 28,825 J / (mol • K). Keressük meg az 1 l szén-dioxid fajlagos hőjét állandó nyomáson.
A 1 mól szén-dioxid fajlagos hőjének ismeretében 1 liter szén-dioxid izobár hőteljesítményt találunk: