Propilén reakcióegyenlet hidratálása
Az ökológiai kérdések fontos helyet foglalnak el életünkben. Ők a polimerek fő összetevője, amely körülvesz minket mindenhol: ezek műanyag zacskók és gumik, valamint sok más anyag. A polipropilén nem ez a sorozat utolsó lépése. Ez is része a különböző anyagoknak, és számos iparágban használják, mint pl. Az építőipar, a háztartási alkalmazást mint műanyag csészék és más kis (de nem termelési méretarányú) igényeket. Mielőtt olyan folyamatról beszélne, mint a propilén hidratálása (ennek köszönhetően izopropilalkohol is származhat), forduljunk az alapvető anyag felfedezésének történetéhez az iparág számára.
Mint ilyen, a felfedezés időpontja nem rendelkezik propilénnel. Polimert, polipropilént azonban 1936-ban a híres német kémikus Otto Bayer fedezte fel. Természetesen elméletileg tudták, hogyan szerezhet ilyen fontos anyagot, de gyakorlatilag nem volt lehetséges. Sikerült csak a huszadik század közepéig, amikor a német és olasz kémikusok és a Ziegler Nutt nyitott telítetlen szénhidrogén polimerizációs katalizátort (amely egy vagy több kettős kötést tartalmazó), amely ezt követően, és elemzi: Ziegler-Natta-katalizátorok. Ettől a pontig teljesen lehetetlen volt ilyen anyagok polimerizációs reakcióját megtenni. Polikondenzációs reakciókat ismertek, ahol a katalizátor hatása nélkül az anyagokat egy polimerláncba egyesítve, így mellékterméket képezve. De ez telítetlen szénhidrogénekkel nem volt lehetséges.
Az anyaghoz kapcsolódó másik fontos folyamat a hidratáció volt. A propilén alkalmazásának évében elég sok volt. És mindez a különböző olaj- és gázfeldolgozó vállalatok által feltalált módszereknek köszönhetően a propén gyógyítására szolgáló módszereknek köszönhető (ezt néha más néven a leírt anyagnak is nevezik). A Nyersolaj krakkolásából volt egy melléktermék, és amikor kiderült, hogy annak egy származékát, izopropil-alkohol, az alapja a szintézis sok hasznos anyagok az emberiség számára, sok vállalat, mint például a BASF, szabadalmaztatott azok gyártási és elindított egy hatalmas kereskedelmi ebben az összefüggésben. A propilén hidratálását megvizsgálták és a polimerizáció előtt alkalmazták, ezért az aceton, a hidrogén-peroxid és az izopropilamin elkezdődött a polipropilén előtt.
Nagyon érdekes a propén és az olaj közötti elválasztási folyamat. Az, hogy most fordulunk.
Propilén izolálása
Valójában az elméleti értelmezésben a fő módszer csak egy folyamat: az olaj és a kapcsolódó gázok pirolízise. De a technológiai megvalósítások csak a tenger. Az a tény, hogy minden vállalat célja az, hogy egyedülálló módon, és védi a szabadalmi és más hasonló cégek is keresi a saját módon is, hogy eladja, propén nyersanyagként vagy kapcsolja be a különböző termékeket.
A pirolízis ("piro" - tűz, "lízis" - megsemmisítés) egy komplex és nagy molekula bomlásának kémiai folyamata a kisebb hőmérsékletű és katalizátor hatására. Az olaj, mint ismeretes, szénhidrogének keveréke, könnyű, közepes és nehéz frakciókból áll. Az első, a legkisebb molekuláris, és propén és etán a pirolízisben. Végezze el ezt a folyamatot speciális sütőkben. A legfejlettebb gyártók közül ez a folyamat technológiailag különbözik: egyesek homokot használnak hűtőfolyadékként, mások - kvarc, mások - koksz; Lehetőség van a kemencék szerkezetének megfelelően történő megosztására is: vannak csőszerű és hagyományos reaktorok, amelyeket úgy neveznek.
A pirolízis folyamata azonban nem elegendő tiszta propént biztosít, hiszen ezen túlmenően hatalmas mennyiségű szénhidrogént alakítanak ki, amelyet energiafogyasztó módszerekkel kell elválasztani. Ezért a következő hidratáláshoz tisztább anyagot állítunk elő, az alkánok dehidrogénezését is alkalmazzuk: a mi esetünkben a propán. Csakúgy, mint a polimerizáció, a fenti folyamat csak nem történik meg. A végső szénhidrogén puffárából származó hidrogén hasítása katalizátorok hatására történik: háromértékű króm-oxid és alumínium-oxid.
Nos, mielõtt a hidratálási folyamat történetéhez fordulnánk, nézzük meg telítetlen szénhidrogének szerkezetét.
A propilén szerkezetének jellemzői
A propén maga az alkének egyike (a kettős kötésű szénhidrogének) második tagja. Könnyebb volta miatt ez csak az etilénnek felel meg (amiből kiderül, hogy polietilén készült - a világ legnagyobb tömegű polimerje). A szokásos állapotban a propéngáz, hasonlóan az alkáncsaládhoz "relatív", propán.
De a lényeges különbség a propán és a propén között az, hogy az utóbbi összetételében kettős kötés van, amely alapvetően megváltoztatja kémiai tulajdonságait. Ez lehetővé teszi, hogy más anyagokat csatlakoztasson a telítetlen szénhidrogén molekulájához, ami teljesen más tulajdonságokkal rendelkező vegyületeket eredményez, amelyek gyakran nagyon fontosak az iparban és a mindennapi életben.

A hidratáció elmélete
Először forduljunk egy általánosabb folyamatba - szolvatáció -, amely magában foglalja a fent leírt reakciót is. Ez a kémiai átalakulás, amely abból áll, hogy az oldószer molekuláit az oldott anyag molekuláihoz kapcsolják. Ebben az esetben új molekulákat vagy ún. Szolvátokat képezhetnek, - oldott anyag molekuláiból és oldószerből álló részecskék, amelyek elektrosztatikus kölcsönhatásban kapcsolódnak. Csak az első típusú anyagok érdekelnek, sőt, propilén hidratálásakor főleg ez a termék képződik.
A fent leírt módon történő szolvatálás során az oldószer molekuláit az oldott anyaghoz csatlakoztatjuk, új vegyületet kapunk. A szerves kémiai hidrátokban főleg alkoholokat, ketonokat és aldehideket állítanak elő, de számos más eset is létezik, mint például a glikolok képződése, de nem érjük hozzá őket. Valójában ez a folyamat nagyon egyszerű, ugyanakkor meglehetősen bonyolult.

Hidratáló mechanizmus
A kettős kötés, mint ismeretes, kétféle összetevõ atomból áll: pi és sigma kötések. A hidratálási reakcióban a Pi-kötés mindig először törik, mert kevésbé erős (alacsonyabb kötési energiával). Amikor megszakad, két üres pályája két szomszédos szénatomon alakul ki, amelyek új kötéseket képezhetnek. Egy vízmolekula, amely két részecske formájában található oldatban létezik: egy hidroxidion és egy proton, képes összekapcsolódni egy törött kettős kötésen keresztül. Ebben az esetben a hidroxidion a központi szénatomhoz kapcsolódik, és a proton a második, extrém. Így a propén hidratálásakor túlnyomórészt propanol 1 vagy izopropil-alkohol keletkezik. Ez egy nagyon fontos anyag, mert amikor oxidálódik, kaphat acetont, amelyet masszívan használnak a mi világunkban. Azt mondtuk, hogy főként azért alakult ki, de nem így van. Ezt kell mondanom: az egyetlen termék a propilén hidratálásakor keletkezik, és ez az izopropanol.
Ez persze minden finomság. Valójában mindent le lehet írni sokkal könnyebb. És most megtudjuk, hogy az iskola tanfolyama rögzíti a folyamatot, például a propilén hidratálását.
Reakció: hogyan történik
A kémiai folyamatokban mindent egyszerűen egyszerűen hívnak: reakcióegyenletek segítségével. Így a tárgyalt anyag kémiai átalakulása így írható le. A propilén hidratációja, amelynek reakciója nagyon egyszerű, két lépésben folytatódik. Először megszakítja a pi-linket, amely része a dupla. Ezután a víz molekula formájában két részecske hidroxid aniont és hidrogén kation, alkalmas propilén-molekula, amely az aktív idő a két üres helyet, hogy kötést képezzen. A hidroxidion kötést köt össze egy kevésbé hidrogénezett szénatommal (vagyis egy, amelynél kevesebb hidrogénatom kapcsolódik), és a protonhoz, a fennmaradó extrémhez. Így egyetlen terméket kapunk: a korlátozó egyértékű alkohol izopropanol.
Hogyan lehet rögzíteni a reakciót?
Most megtanuljuk írni egy olyan kémiai reakciót, amely tükrözi a folyamatot, például a propilén hidratálását. A képlet segít nekünk: CH2 = CH-CH3. Ez a kiindulási anyag - propén. Amint látható, kettős kötés van jelölve "=", és ezen a helyen van víz, amikor a propilén hidratálása megtörténik. A reakcióegyenlet a következőképpen írható le: CH2 = CH-CH3 + H20 = CH3-CH (OH) -CH3. A zárójelben lévő hidroxilcsoport azt jelenti, hogy ez a rész nem a képlet síkjában van, hanem alacsonyabb vagy magasabb. Itt nem tudjuk megmutatni a három csoport közötti szögeket, amelyek eltérnek az átlagos szénatomtól, de azt mondjuk, hogy közel azonosak egymással és 120 fokosak.
Hol van ez?
Már említettük, hogy a reakció során kapott anyagot aktívan használják más fontos anyagok szintéziséhez. Ez nagyon hasonló szerkezetű acetonban, ahonnan csak abban különbözik, hogy ahelyett, hogy ott áll gidroksogrupp keto (azaz, oxigénatom kapcsolódik egy kettős kötéssel egy nitrogénatomhoz). Mint ismeretes, az aceton önmagában használják lakkok és oldószerek, de emellett ez a reakciópartnerként használt további szintézisében összetettebb anyagok, mint a poliuretánok, epoxigyanta, ecetsav-anhidrid, és így tovább.
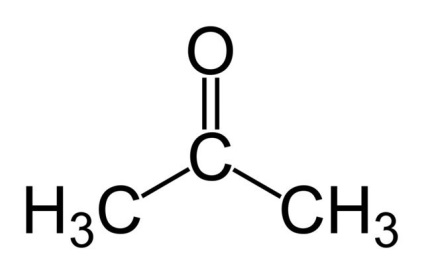
Az aceton előállítására szolgáló reakció
Úgy véljük, feleslegessé válna az izopropilalkohol átalakítása acetonra, különösen, mivel ez a reakció nem annyira bonyolult. Először a propanolt elpárologtatják, és 400-600 ° C-on oxigéneznek egy speciális katalizátorral. Egy nagyon tiszta terméket kapunk, ha a reakciót ezüsthálóra hajtjuk végre.

A reakcióegyenlet
Nem fogunk részletesen megismerni a propanol aceton oxidációjának reakció mechanizmusát, mivel nagyon összetett. Korlátozzuk magunkat a szokásos egyenlet kémiai reakció: CH3 - CH (OH) - CH3 + O2 = CH3 - C (O) - CH3 + H2 O. Mint látható az ábrán minden elég egyszerű, de szükséges, hogy ásni a folyamat, és akkor szembe számos nehézséggel .
következtetés
Ezért megszüntettük a propilén hidratálásának folyamatát, és megvizsgáltam a reakció egyenletét és az áramlás mechanizmusát. A figyelembe vett technológiai alapelvek a termelésben előforduló valódi folyamatok alapját képezik. Amint kiderült, nem túl bonyolult, de valódi haszna van a mindennapi életünkben.
