Foszfor és vegyületei, kémiai és kémiai vegyszerek készítése
A PHOSPHORUS ATOM SZERKEZETE
A foszfor a III. Szakaszban található, a fő "A" alcsoport 5. csoportjában, a sorozatszám alatt. Relatív atomtömeg Ar (P) = 31.
1 S 2 2 S 2 2 P 6 3 S 2 3 P 3. Foszfor: p-elem, nem metál
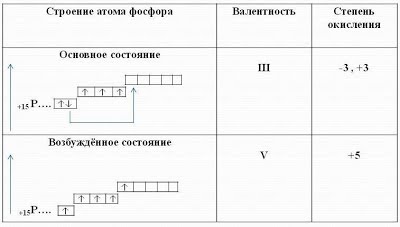
A foszfor értékes lehetőségei szélesebbek a nitrogénatoméhoz képest, mivel a foszforatomban szabad d-orbitálisok vannak. Ezért 3 S2 elektron párosítása előfordulhat, és egyikük átmegy a 3 d-orbitálisra. Ebben az esetben a foszfor harmadik energiaszintjén öt párosítatlan elektron van, és a foszfor a V valenciáját mutathatja.
Szabad állapotban a foszfor különböző allotropikus módosításokat eredményez: fehér, vörös és fekete foszfor
A természetben
A PHOSPHORUS CSATLAKOK BIOLÓGIAI SZEREPE
Foszfor van jelen az élő sejtekben, mint az orto- és pirofoszforsav savak, egy része a nukleotidok, nukleinsavak, fosfoproteidov, foszfolipidek, koenzimek, enzimek. Az emberi csontok 3Ca3 (PO4) 3 · CaF2 hidroxiapatititból állnak. A fogzománc összetétele a fluorapatit. A foszforvegyületek emberi szervezetben és állatokban történő átalakulásának fő szerepe a máj. A foszforvegyületek cseréjét hormonok és D-vitamin szabályozzák. A foszfor napi humán igénye 800-1500 mg. A szervezetben a foszfor hiányában különböző csontbetegségek alakulnak ki.
· A vörös foszfor gyakorlatilag nem toxikus. A vörös foszfor portja, a tüdőbe jutva, tüdőgyulladást okoz krónikus beavatkozás esetén.
· A fehér foszfor nagyon mérgező, lipidekben oldódik. A fehér foszfor halálos dózisa 50-150 mg. A bőrre jutó fehér foszfor súlyos égési sérülést okoz.
Az akut mérgezést a foszforral a szájban és a gyomorban, a fejfájásban, a gyengeségben, a hányásban égő tünetek jelentik. 2-3 nap elteltével sárgaság alakul ki. A krónikus formákat a kalciummetabolizmus, a kardiovaszkuláris és az idegrendszeri károsodások sérelme jellemzi. Elsősegély az akut mérgezéshez - gyomormosás, hashajtó, tisztító beöntések, intravénás glükózoldatok. Amikor a bőr égett, kezelje az érintett területeket réz-szulfáttal vagy szóda oldattal. A levegőben lévő foszforgőz MPC értéke 0,03 mg / m³.
A foszforot apatitokból vagy foszforitokból nyerik, a koksz és szilícium-dioxid kölcsönhatásából 1600 ° C hőmérsékleten:
A kapott fehér foszforpárok párhuzamosan a víz alatt vízzel kondenzálódnak. Foszforot helyett más vegyületek redukálhatók, például metafoszforsav:
A PHOSPHORUS KÉMIAI TULAJDONSÁGAI
A foszfor fontos biogén elem, ugyanakkor széles körben alkalmazható az iparban.
Talán a foszfor első tulajdonsága, amelyet egy ember üzembe helyez, a gyúlékonyság. A foszfor elégetése nagyon magas, és függ az allotropikus módosításoktól.
A legaktívabb kémiai, mérgező és éghető fehér ("sárga") foszfor. mert gyakran használják (lángoló bombákban stb.).
A vörös foszfor az iparág által termelt és fogyasztott legfontosabb módosítás. Ezt alkalmazzák a termelés mérkőzések azt finomra zúzott üveg és a ragasztó az oldalfelületén a doboz, a súrlódást a gyufafej készítmény, amely kálium-klorát és kén, gyújtás bekövetkezik. A vörösfoszforot robbanóanyagok, gyújtó vegyületek, üzemanyagok előállításához használják.
A foszforok (a foszfátok formájában) - a három legfontosabb biogén elem egyike - részt vesznek az ATP szintézisében. A legtöbb foszforsav foszfortartalmú műtrágya - szuperfoszfát, csapadék stb.
Foszfor-oxid (V) - foszforsav-anhidrid
Fizikai tulajdonságok: Foszfor-oxid (V) P2 O5 - fehér higroszkópos por (felszívja a vizet), szigorúan zárt tartályokban kell tárolni.
Előkészület: Ez a levegő vagy oxigén feletti foszfor elégetésével érhető el
Alkalmazás: A foszfor-oxid (V) nagyon erősen keveredik a vízzel, és eltávolítja a vizet más vegyületekből. Légtisztítóként használják gázok és folyadékok esetén.
Kémiai tulajdonságok: A foszfor-oxid (V) savas oxid. kölcsönhatásba lép, mint más savas oxidok vízzel, bázikus oxidokkal és bázisokkal.
A foszfor-anhidrid speciális módon reagál a vízzel, és a szokásos körülmények között (fűtés nélkül) kölcsönhatásba lép a vízzel. mindenekelőtt a metafoszforsav ΝРО3:
fűtött, ortofoszforsav H3P04:
A leginkább praktikus érték az ortofoszforsav-H3P04.
A molekula felépítése: A foszforsav egy molekulájában a hidrogénatomok oxigénatomokkal kapcsolódnak:
Fizikai tulajdonságok: A foszforsav színtelen, higroszkópos, vízben könnyen oldható szilárd.
1) A foszfor (V) -oxid vízzel való kölcsönhatása melegítéskor:
2) A természetes só - kalcium - ortofoszfát és a kénsav kölcsönhatása melegítéssel:
3) A foszfor és a koncentrált salétromsav kölcsönhatása