Elektrokémiai analfabetizmus elektrolízis
Az alábbiakban olvashatjuk az olvasóknak, hogy világosabbak, mivel az elektrokémiai tudománynak növelnie kell az energiahatékonyságot.
Tehát a víz elektrolízise, azaz a víz elektrolízise. hidrogénre és oxigénre bomlanak (1):
(1)
Figyelembe véve, hogy ez egy endotermikus folyamat, azaz az energia felszívódásával áramlik, a gazdasági jelentésének kérdése felmerül. Igaz, hogy nem vagyok hatáskörömben, de feltételezhetem, hogy a jelentés lehet pl. A hidrogén felhasználása az energia tárolására.
Az aktuális kimenet számos tényezőtől függ: az elektrolit összetételétől és hőmérsékletétől, az anyagtól és az elektródák állapotától, az áramtól és a feszültségtől. E paraméterek bizonyos határokon belüli változtatásával optimalizálható a célelektrokémiai folyamat energiaköltsége.
A káros reakciók természetesen a termodinamikai képességük (lásd alább) és nem nulla sebesség (lásd alább) következménye.
2) Az elektródák viselése anyag, nem energiaveszteség. Azonban az elektródák gyártásához is szükség van energia felhasználására, így ezt a tételt is magába vettem. Az anódok gyakrabban kopottak - oxidációs folyamatok zajlanak rájuk. A katódok is lebomolhatnak, ha az elektrolit eléggé agresszív.
Az anód szilárdsága összetételének és szerkezetének, valamint az áramsűrűségnek a függvénye.
3) A legnehezebb megérteni a harmadik jelenség - túlfeszültség. Megpróbálom elmagyarázni a lényegét.
Az elektrolízis lehetővé tétele érdekében bizonyos potenciális különbségeket kell alkalmazni a katódra és az anódra. A minimálisan szükséges potenciálkülönbséget a Nernst-egyenlet (5) segítségével kell figyelembe venni:
, (5)
ahol
E a fél reakcióelektród potenciálja, B;
E ° a felezési reakció standard elektróda potenciálja, B;
R a gáz állandó, 8,314 J / (mol × K);
T a hőmérséklet, K;
n a fél reakcióban részt vevő elektronok száma;
F - Faraday konstans, 96500 Ci / mol.
- az oxidált formák tevékenysége (fugitivitás);
- a helyreállított formák tevékenysége (vakságossága).
Így a félreakció (4) elektródpotenciálja a (6) formában írható:
(6)
Íme egy példa.
Amikor a víz lebomlik (savas oldatokban), az oxigén oxigén oxidációja folytatódik:
Ea ° = 1,36 V
A katódon hidrogénre áll vissza:
E ° = 0 V
A legkisebb potenciálkülönbség (ΔE), amelyet az elektródákon kell alkalmazni az elektrolízis indításához, ΔE = Ea - Ek. Abban az esetben, ez az érték a víz standard körülmények között (hidrogén-ion aktivitása 1, a nyomás, a különösen aprólékos - fugacitás, oxigén és 1 atm hidrogén, akkor a második tagja a Nernst-egyenlet értéke 0, és E = E °) lesz 1,36 V. Azonban, a valóságban ez a feszültség gyakran nagyobb összeggel az úgynevezett túlfeszrelé Δφ, amely egyébként, attól függ, hogy az áramsűrűség egy adott elektród Δφ = f (j), az elektród anyagot és annak felületének állapotát.
Hol származik a túlképzés?
A túlfeszültség okai kinetikusak, pl. az elektrokémiai reakció sebességével összefüggésben.
Tekintsük a reakciót, fordítsuk meg a víz elektrolízisét: a robbanásveszélyes gáz robbanását, pl. 2 térfogat hidrogén és 1 térfogat oxigén elegyét. A reakció kíséri alakulása nagy mennyiségű hőt, de szobahőmérsékleten nem szivárog, mert a magas aktiválási energia (Ea feltüntetett ábrát) - a potenciálgát amelyeket ki kell küszöbölni az erős hidrogén és oxigén molekulák. A robbanás bekövetkezése esetén a keveréket tűzbe kell helyezni, azaz hő, növelve egyes molekulák potenciális energiáját. Lehetőség van katalizátor, például finom eloszlású platina hozzáadására, ami csökkenti az aktivációs energiát.
Túlfeszültség - elektrokémiai ekvivalens az aktiválási energia, ez tükrözi a kiegészítő (összehasonlítva a termodinamikai által kiszámított Nernst-egyenlet) energiaköltségek, amelyeket ki kell küszöbölni, hogy elektrolízis, az arány magas volt.
A túlfeszítésnek számos összetevője van.
Az elektrolízis során a közeli elektródréteget az ionok ürítik ki, amelyek a megfelelő elektródon kerülnek kibocsátásra. Így a koncentráció-értékek, amelyeket be kell behelyettesíteni a Nernst-egyenlet nem felel meg azokkal, melyek a tömeges elektrolit, és ennélfogva a potenciális különbség, amelynél elektrolízis tovább fog növekedni. Ezt a túlfeszültséget a koncentrációnak nevezzük. A koncentráció túlfeszültségének esetében további energiaköltségekre van szükség a diffúzió, a migráció és a potenciálisan meghatározó ionok konvektoros átvitelének hatásainak leküzdése érdekében.
A koncentráció túlfeszültségét az elektrolit elektromos vezetőképességének összekeverésével és növelésével megszüntetjük.
A túlfeszültség második komponense a kémiai reakció eredménye. Ez lehet egy szokásos kémiai reakciók előforduló az elektróda réteg vagy az elektród felületén, az adszorpciós-deszorpciós folyamatok és elektrokémiai reakció társított elektrontranszfer közvetlenül a fázishatár az elektróda egy molekula vagy ion. Ezt a túlcsordulást néha reakciósnak nevezik.
Ha az elektronátvitel a leglassabb szakasz, azt mondják, hogy az elektrokémiai szakasz túlfeszített. Ebben az esetben további energiaköltségekre van szükség az elektróda anyagának elektronenergiájának növeléséhez. Meg kell növelni a potenciális energiát a reagens megfelelő kémiai kötéseinek energiájához, és megkönnyíteni az alagutatásukat a közel elektródrétegben lévő reagenshez.
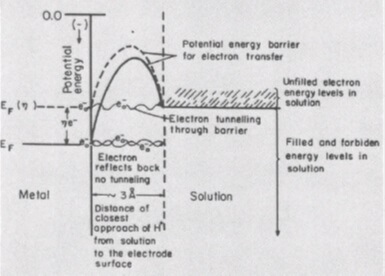
A túlfeszültség harmadik fázisa abban az esetben jelenik meg, ha az elektrolízis új fázis-gáz buborékok vagy fémfilm kialakulásához kapcsolódik. Ebben az esetben további energiaköltségekre van szükség a felületi feszültség leküzdésére az új fázis nukleációjának szakaszában. A felületaktív anyagok elektrolitjának kiegészítése segít a fázis túlcsordulásának eltávolításában.
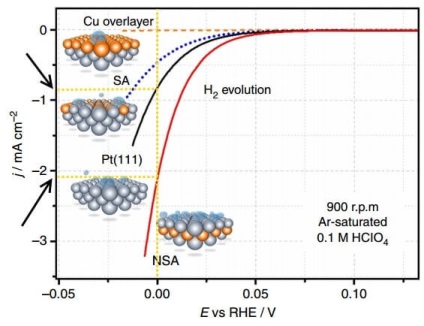
Az ábrán a hidrogénfejlődés (H2 evolúció) különböző elektródákon az áramsűrűség (j) függvénye a potenciálra (E, relatív RHE, azaz reverzibilis hidrogénelektróda) függ.
A polarizáció az egyensúlyi elektródpotenciál (azaz áram hiányában) és az áram alatt lévő potenciáljának, azaz nagyjából elmondható, hogy egy adott elektróda túlfeszültség. A fenti gráfban ez az elektróda polarizációja, amelyen a hidrogén felszabadul. Az elektrokémiai áramsűrűség a kémiai reakció sebességének kifejező módja. Így minél nagyobb az áramsűrűség a kisebb túlfeszültséggel (polarizáció), annál jobb, azaz jobb. annál gyorsabban halad a folyamat, és kevesebb energiát fordítanak annak végrehajtására.
Összehasonlítsuk az áramsűrűséget E = 0 V értékkel egy platina nem módosított Pt (111) elektróda és NSA-val módosított réz-réteg részarányával. A módosított elektródon egységnyi idő alatt körülbelül kétszer annyi hidrogént szabadít fel.
Ebből a szempontból a túlfeszültség csökkentése minden bizonnyal növeli az elektrolízis hatékonyságát. Más kérdés, hogy az elektrolízis hatékonyságának kiszámításához a vizsgált esetekben valószínűleg további méréseket és számításokat kell elvégezni, amelyek azt mutatják, hogy a rézelektróda módosított elektródája nem növelheti a hatékonyságot kétszeres mértékben.
Nos, egy kis elmélet záróban.
Ha a koncentráció túlfeszültségét az oldat elektromos vezetõképességének keverésével és növelésével, az elsõ fázisú felületaktív anyagok hozzáadásával lehet csökkenteni, akkor a kémiai reakció során bekövetkezõ reakció túlfeszültségét kiküszöbölik katalizátorok alkalmazásával. A vizsgált esetben egy ilyen katalizátor platinaelektróda réz-réteg volt.
A hidrogén felszabadulása a víz elektrolízisében közbülső részecskék képződéséhez kapcsolódik - az elektródon adszorbeált hidrogénatomok, az úgynevezett adatok. A hidrogén hatékony elkülönítéséhez az adatmemek és az elektróda felülete közötti kötés nem lehet nagyon erős vagy nagyon gyenge. Az ismert tiszta fémek közül az optimális kötési energia a hidrogénadatokkal platina, ezért a hidrogénfejlődés túlfeszültségét a platina egyik legalacsonyabb értéke képezi.