Légköri szennyezés nitrogénvegyületekkel

Kezdőlap | Rólunk | visszacsatolás
A nitrogén-oxidok játszanak kulcsfontosságú szerepet a fotokémiai „szmog” (lásd. A megfelelő előadás), befolyásolja az ózonrétegre (lásd. A megfelelő előadás). Emiatt a szennyezés a légkör nitrogén-oxidok van mind a helyi és globális hatása van a környezetre.
A nitrogén-oxidok légköri szennyezése általában viszonylag kicsi. Azonban a fejlett vegyipari ágazat, különösen a salétromsav-gyárak közelében működő területeken vannak olyan helyi zónák, amelyek nagy NO-tartalmú NO-t tartalmaznak a levegőben.
A troposzférában a nitrogénvegyületeket főleg nitrogén-oxidok, ammónia- és ammóniumsók, valamint salétromsav és nitrátok képviselik. A nitrogén-oxidok közül a dinitrogén-oxidot (N2O), a monoxidot (NO) és a nitrogén-dioxidot (N02) el kell különíteni. Egyéb nitrogénvegyületek oxigénnel (N03, N203, N204, N205) instabilak troposzférikus körülmények között. Például a diazotium-trioxid és a dinitrogén-tetroxid könnyen lebomlik, így NO és NO2 képződik:
A nitrogén-trioxid viszonylag gyorsan fotodiszszociálódik vagy más szennyeződésekkel kölcsönhatásba lép:
Dinitrogén-pentoxid is instabil a troposzférában és a vegyület elbomlik alkotnak dinitrogén-trioxiddal és oxigén hatása alatt nedvesség vagy átalakítható salétromsav:
Ezért a nitrogén-oxidok általános képletében az NOx általában NO, N02 és N2O.
Az atmoszféra N2O-ból való eltávolításának főbb folyamatait a fotodiszszociáció folyamatával kapcsolják össze:
vagy egy szingulett-gerjesztett oxigénatommal való kölcsönhatás esetén:
N2 0 + 0 (1 D) 2NO
Az utolsó két reakció körülbelül azonos ütemben zajlik. Mivel a koncentráció a troposzférában szingulett gerjesztett oxigénatomok alacsony, és gyakorlatilag nincs a hullámhosszú sugárzást a 250 nm l £, N2 O molekulák rendelkeznek a hosszú élettartam, és tudja mozgatni a sztratoszférában. A sztratoszférában a megnövekedett koncentráció 0 (1 D) tartalmaz, és a változási folyamatok a spektrum napsugárzás tompított aránya megsemmisítése molekulák N2 O drámaian növekszik. Ezért, a koncentráció a N2 O 35 km mintegy 10-szer kisebb, mint a troposzférában.
A fő természetes forrásai a nitrogén-oxidok (denitrifikálási eljárás, NH3 oxidáció. Oxidációs és nitrogén kisüti villámlás) évente a troposzférában szállít 21-89 millió tonna NOx számítva elemi nitrogénné. Ezen túlmenően, az eredmény az emberi eredetű kibocsátások még mindig mintegy 20 millió tonna nitrogén oxidok formájában a légkörbe kerül. Mind a természetes, mind az antropogén kibocsátás túlnyomórészt NO-t tartalmaz.
A nitrogén-oxid-képződés egyik fő forrása a levegő nitrogén oxidációja, amely minden olyan égési folyamatot kísér, amelynél oxidálószerként levegőt alkalmaznak. Ahogy a hőmérséklet nő, a nitrogén-oxid egyensúlyi mennyisége növekszik. A nitrogén-oxidok légköri szennyezésének fő forrása a fosszilis tüzelőanyagok égetése a hőerőművekben és a gépjárművekben égő üzemanyag.
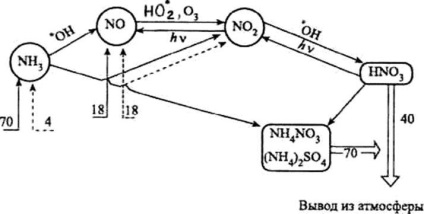
A nitrogénvegyület légköri ciklusa (évente - millió tonna elemi nitrogén):
® - nitrogénvegyületek természetes bejuttatása;
---® - a nitrogénvegyületek antropogén bemenetei;
Þ - visszavonulás a légkörből
A troposzférában N0, amely kölcsönhatásba lép a hidroperoxid gyökökkel, nitrogén-dioxid lesz:
A nitrogén-oxid oxidálásának másik lehetséges módja az ózonkal való kölcsönhatás:
Nitrogén-dioxid a troposzférában az 1. hullámhosszú sugárzás jelenlétében <398 нм разлагается с образованием оксида азота и атома кислорода:
Az eredményül kapott nitrogén-monoxidot ismét az oxidációs folyamatnak vetjük alá, és az atomi oxigén az ózon megjelenését eredményezi a troposzférában.
A nitrogénvegyületek légköri ciklusának fontos része (lásd az ábrát) Salétromsav keletkezése. A troposzférában a salétromsav körülbelül 44% -a a nitrogén-dioxid és a hidroxilgyök közötti kölcsönhatás eredményeképpen jön létre:
A HNO3 körülbelül 24% -a jelenik meg a légkörben a diazotén-pentoxid H2O molekulákkal való kölcsönhatásának eredményeként az (1) egyenlet szerint. A légkörben felszabaduló teljes salétromsav legfeljebb 28% -át a nitrogén-trioxid szerves oxigéntartalmú gyökökkel való kölcsönhatása képezi.
A salétromsav egy része bomlik dioxid vagy nitrogén-trioxid keletkezésekor, amelyek újra beletartoznak a nitrogénvegyületek légköri ciklusába (lásd az ábrát):
A kénsavtól eltérően a salétromsav hosszú ideig a gázállapotban maradhat, mivel rosszul kondenzálódik. A salétromsav gőzök felszívódnak a légkörben, felhők vagy aeroszol részecskék cseppjei.
A fő salétromsav mennyiség a troposzférából származik, atmoszférikus kicsapással a HN03 és sói.
Az ammónia fontos szerepet játszik a nitrogénvegyületeket érintő légköri folyamatokban. A vizes oldatban az ammóniának lúgos reakciója van, amely semlegesítheti a légköri savas vegyületeket:
Ezek a kémiai reakciók ammónium-szulfát és nitrát képződéséhez vezetnek.
A légköri ammónia legfontosabb forrása a talaj. A talajban lévő szerves anyagok érzékenyek a mikrobiológiai pusztításra. Az ammónia a szerves anyagok megsemmisítésének egyik terméke. Különösen nagy mennyiségű ammónia szabadul fel a háziállatok bűzött vizeletben. Európában például ez a forrás még jelentősebb, mint az ammónia felszabadulása a talajból. Fontos forrás a nitrogén műtrágyák termelése és alkalmazása a talajra. Az ammónia áramlása a légkörbe a szén vagy a motorolaj elégetése következtében elenyésző.
Évente természetes forrásokból mintegy 70 millió tonna ammónium-nitrogén lép be a légkörbe a nitrogén tekintetében. Az ammónia atmoszférikus szennyezéshez való antropogén hatása csak mintegy 4 millió tonna.
A légköri csapadék és a száraz lerakódási folyamatok eredményeképpen évente körülbelül 70 millió tonna ammóniumvegyületet távolítanak el a légkörből. Az ammónia egy része (évi 3-8 millió tonna) kölcsönhatásba lép a szabad gyökökkel, főként egy hidroxilcsoporttal:
A jövőben · Az NH2 könnyen oxidálható nitrogén-monoxiddá.