Kemény, közbenső és lágy savak és bázisok minőségi megoszlása
3.2.2. A kúszóság elvének alkalmazása
Szerves reakciók. Hadd mutassuk be, hogy a táblázatban szereplő adatok hogyan. 3.1-et lehet használni az egyensúlyi helyzet megjóslásához. A metanol és a metil-jodid formálisan OH- (kemény) és I- (puha) lágy savas CH3 + bázisok semlegesítő termékei. Ezután alapján HSAB elv „megjósolni”, hogy az egyensúlyi kell jobbra tolódott a reakcióban a metanol a hidrogén-jodid, mivel ez a kapcsolat vannak kialakítva megfelelő kölcsönhatás „soft-lágy” és „kemény-kemény.”
Valójában az egyensúlyi konstans nagyon magas: K »10 9 25 ° C-on.
Egy másik reakcióban az acilkation (CH3C + = 0, keménysav) átjut az RS lágy alapanyagból a kemény bázis OH-hoz. és ezért a "must" egyensúlyt jobbra kell tolni:
Valójában a kísérlet azt mutatja, hogy a tioéterek nagyon könnyen reagálnak vízzel és alkohollal kissé lúgos közegben.
A GICS elvét széles körben használják a szerves kémia, és ezt a könyvet a későbbi fejezetekben fogjuk használni. Például, ez az elv nagyon hasznos leírásánál módon reakciókban ambidens nukleofilek, amelyek az enolátot ionok elektrofil reagensek (17. fejezet):
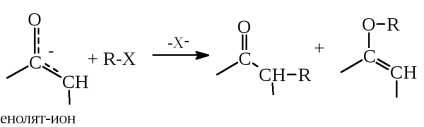
valamint elektrofilek, például a, b-telítetlen karbonilvegyületek, nukleofilekkel (16. fejezet):
Az első esetben, az enolát ion nukleofil szénatom centrum lágyabb, mint az oxigén, és ezért így az alkilezési termék szén felett, ha a „sav-rész” elektrofil R-X (azaz R +) egy lágy Lewis-sav. A második reakcióban a lágyabb Y - nukleofil. annál nagyobb az affinitás a lágyabb elektrofil centrumhoz - a b-szénatomhoz, nem pedig a merevebb karbonilhez. Ezért a lágy nukleofilekre a C-C kötés hozzáadása a b-atomhoz növekszik (Michael reakció, lásd 16. fejezet).
Szimbiózis. A merevség és a lágyság a donor és akceptor atom a bázisok és savak, illetve befolyásolja a merevséget vagy lágyság a szubsztituensek jelen a molekulában, mielőtt a képződését az adduktot. Ezt a hatást "szimbiózisnak" nevezték. Ennek lényege, hogy a lágy szubsztituensek savakat és bázisokat képeznek, a lágyabb, kemény szubsztituensek pedig még merevebbé teszik azokat. Például a [Co (NH3) 5F] 2 + stabilabb, mint a [Co (NH3) 5I] 2+. mivel az NH3 kemény bázisa, mint ilyen, növeli a kobalt merevségét, ezáltal jobban hajlamos a fluorid hozzáadására, mint a jodidra. Másrészt, ha az ammóniát egy lágy CN - ligandum váltja fel. akkor a stabilitás invertálódik: a [Co (CN) 5I] 3- stabil, és a [Co (CN) 5F] 3 nem létezik.