A klór atom (cl) szerkezete, a rendszer és a példák
A klór a periódusos rendszer fő (A) alcsoportjának VII.
A p-család elemeire utal. A nemfém. Az elemek - nem fémek, amelyek e csoport részét képezik, együttesen halogénnek nevezik. A jelölés Cl. A szekvencia száma 17. A relatív atomtömeg 35,453 amu.
A klór atomjának elektronikus szerkezete
A klór atom egy pozitív töltésű (17) atomból áll, amely 17 protonból és 18 neutronból áll, amelyek körül 17 elektron mozog a 3 pályán.
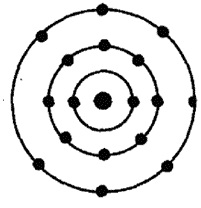
1. ábra. A klóratom vázlatos szerkezete.
Az orsók mentén az elektronok eloszlása a következő:
A klór atom külső energia szintjén hét elektron van, mindegyiket valenciának tekintjük. A talajállapot energia diagramja a következő formában jelenik meg:
Egy párosítatlan elektron jelenléte azt jelzi, hogy a klór képes +1-es oxidációs állapotot mutatni. Emellett számos izgatott állapot is lehetséges a 3d-orbitális üresedése miatt. Először is, a 3p alsórész elektronjai párosítanak és elfoglalják a szabad d-orbitálisokat, majd ezt követően a 3s-subwoofer elektronjait:
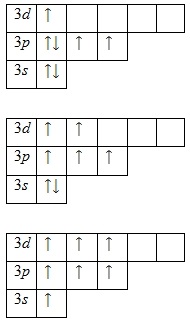
Ez magyarázza a klór jelenlétének további három oxidációs fokát: +3, +5 és +7.
Példák a problémamegoldásra
Két Z = 17 és Z = 18 nukleáris töltettel rendelkező elemet kapunk. Az első elem által létrehozott egyszerű anyag egy éles szagú mérgező gáz, a második pedig nem toxikus, szagtalan, nem lélegző gáz. Írj elektronikus képleteket mindkét elem atomjaihoz. Melyik toxikus gáz?
Az egyes elemek elektronikus formáit a következőképpen írjuk fel:
A kémiai elem atomjának töltése megegyezik az időszakos táblázatban szereplő rendszámával. Ezért klór és argon. Két klóratom egy egyszerű anyag - Cl2 molekulát képez. amely éles szagú toxikus gáz
Nevezze meg azoknak az elemeknek a nevét, amelyek atomjaiban az energiatartományok eloszlása az alapállapotban megfelel a számsorozatnak: a) 2.8.7; b) 2,8,8,1; c) 2, 8, 13, 1; d) 2.8 18.1. Kik közülük ugyanabba a csoportba tartoznak? Mi egy bizonyos időszakban?
A kémiai elem helyének meghatározásához a periódusos táblázatban hozzáadhatod az atomban rendelkezésre álló összes elektronot, nem számítva az energiaszint feletti eloszlását:
a) 2 + 8 + 7 = 17. Ez klór.
b) 2 + 8 + 8 + 1 = 19. Ez kálium.
c) 2 + 8 + 13 + 1 = 24. Ez króm.
d) 2 + 8 + 18 + 1 = 29. Ez réz.
Az egyik csoportban az első, de különböző alcsoportok a kálium és a réz. A kálium és a króm egy időben - a negyedik.