Termodinamikai rendszer belső energiája Szabadságfokok száma
Egy fontos termodinamikai jellemző a XYZ rendszer belső energiyaU - kaotikus energia (hő Vågå) mozgást végző rendszerek mikrorészecskék (molekulák, atomok, elektronok, nukleáris, stb ...) és a kölcsönhatási energia a részecskék. Ebből a definícióból következik, hogy a belső energia nem tartalmazza a rendszer mozgásának kinetikus energiáját és a rendszer potenciális energiáját a külső területeken.
Belső energia - az egyik funkciója a termodinamikai rendszer állapotát, vagyis az egyes államokban, a rendszer egy jól meghatározott belső energia (nem attól függ, hogy a rendszer megérkezett állapotban) ... Ez így van
azt jelenti, hogy amikor egy rendszer egyik államról a másikra vált, a belső energia változását csak az ezen állapotok belső energia értékeinek különbsége határozza meg, és nem függ az átmenet útjától. Az 1. §-ban bemutattuk a szabadsági fokok számát - a független változók számát (koordinátákat), amelyek teljesen meghatározzák a rendszer helyét a térben. Számos probléma esetén a monatomgáz molekuláját (77. ábra, a) anyagi pontnak tekintjük, amelyhez három
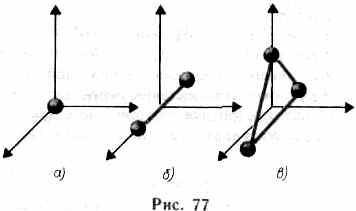
a transzlációs mozgás szabadságának mértéke. A forgási mozgás energiája figyelmen kívül hagyható (r-> 0, J = mr 2 ®0, Tvp = Jw 2 / 2®0).
A klasszikus mechanikában a diatómikus gázmolekulát az első megközelítésben két olyan anyagpont halmazaként tekintik, amely mereven csatlakozik nem deformált csatolással (77. ábra, b). Ez a rendszer a progresszív mozgás szabadságának három fokozata mellett két fokozatú forgási mozgást biztosít. A harmadik tengely körüli forgás (a két atomon átmenő tengely) értelmetlen. Így a diatómikus gáznak öt fokú szabadsága van (i = 5). A három atom (77.0 ábra) és a poliatomikus nemlineáris molekulák hat szabadságfokot tartalmaznak: három transzlációs és három rotációs. Természetesen nincs merev kapcsolat az atomok között. Ezért valódi molekulák esetén figyelembe kell venni az oszcilláló mozgás szabadságát is.
Függetlenül attól, hogy a molekulák szabadságának teljes fokszáma mennyi, a szabadság három fokozata mindig transzlációs. A fokozatos fokú szabadság egyike sem előnyös a többieknél, így mindegyikük átlagosan egyforma energia, amely az érték 1/3-át teszi ki A klasszikus statisztikus mechanika levezetése Boltzmann az egységes minősítésű energia eloszlását a szabadságfok molekulák: a statisztikai rendszer állapotban termodinamikai egyensúly, mindegyik stupatelnuyu és rotációs szabadsági fokkal az átlagos kinetikus-lic energia ravnayakT / 2 , és minden egyes rezgési szabadság mértékére - a közegben a kT-vel egyenlő energia. A rezgési fokozat „rendelkezik” kétszer-Ener Gia mert számlák nemcsak a kinetikus energia (mint SLE tea-transzlációs és rotációs mozgás zheny), hanem a potenciális, a média beállított értékeket a kinetikus és potenciális energiájának azonosak. Így egy molekula átlagos energiája ahol i a transzlációs szám összege, a molekulák szabad mozgásának rotációs és duplázott száma száma: A klasszikus elméletben az atomok közötti merev kötődéssel rendelkező molekulákat veszik figyelembe; számomra megegyezik a molekula szabadságfokainak számával. Mivel az ideális gáz kölcsönös potenciális energia a molekulák jól lu (molekuláris kölcsönhatás nem létezik), a belső energia, Nye említett egy mól gáz az összege a kinetikus energiáját NA molekulák: A belső energia önkényes tömegű m gáz ahol M a moláris tömeg, v az anyag mennyisége. A termodinamika első törvénye Q = U2-U1 + A; a rendszer állapotának végtelen változásával: ahol - a rendszerbe átvitt infinitezimális hőmennyiség - a rendszer által külsőleg végzett munka. erők, dU - változtatni a belső. energiát.
Az (1) egyenlet a dU meghatározása. t és - függetlenül mért értékeket. P. n. Így a dU az egyes U függvény teljes differenciája (az u mennyiségek, általában véve nem teljes különbségek). Így. bármilyen termodinamikus. a rendszer rendelkezik egy államállapotú energia-energia U-val. Csak a rendszer egyensúlyi állapotát meghatározó paraméterektől függ, és független a folyamattól, amelyhez a rendszert ez a rendszer hozta. Az átadott hő Q és A munkája attól függ, hogy az eljárás melyik folyamatot hajtotta végre, mivel a mennyiségek nem teljes különbségek.Kapcsolódó cikkek