Kis interferáló RNS, az emberi öregedés szisztémás rendszere
Kis interferáló RNS
A vizsgálat a kis gátló RNS-ekre összpontosít, amelyek részt vesznek a génexpresszió szabályozásában
Kis interferáló RNS (siRNS)
Az siRNS hossza 21-25 bp. a dsRNS-ből jönnek létre. Az ilyen RNS-ek forrásai lehetnek a vírusfertőzések, a genomba bevezetett genetikai konstrukciók, hosszú darabok a transzkriptumok részeként és a mobil elemek kétirányú transzkripciója.
A dsRNS-t Ricase Dicer-tel vágjuk 21-25 bp hosszúságú töredékekbe. a 3'-végeken kiálló 2'-nukleotidokkal, amelyek után az egyik szál a RISC része, és irányítja a homológ RNS-ek vágását. A RISC-ben siRNA van jelen, ami megfelel a dsRNS plusz és mínusz szálainak. A siRNS-nek nincs saját génjeik, és hosszú RNS-ek töredékei. A siRNA irányítja a cél-RNS vágását, mivel teljesen kiegészíti azt. A növények, gombák és fonálférgek esetében az RNS-függő RNS-polimerázok szerepet játszanak a génexpresszió elnyomásában. amelyekhez az siRNS is primerekként szolgál (primerek új RNS szintéziséhez). A kialakult dsRNS-t Dicerre vágjuk, új siRNS-ek keletkeznek, amelyek másodlagosak. Ez erősíti a jelet.
RNS interferencia
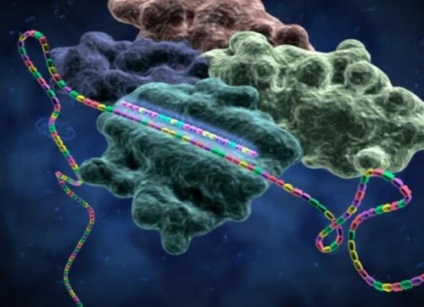
RNS interferencia
Tekintsük a fent leírt RNS-interferenciát a dinamikában
Szerepe a sejtfolyamatokban
Mi az a szerepe a siRNS-nek a sejtben?
Az siRNS a vírusokat védi a sejteket. a transzgének elnyomása, egyes gének szabályozása és a centromer heterokromatin képződése. Az siRNS egyik fontos funkciója a mobil genetikai elemek expressziójának elnyomása. Ilyen szuppresszió előfordulhat mind a transzkripció szintjén, mind a poszttranszkripciós szinten.
Egyes vírusok genomja DNS-ből áll, közülük néhány RNS-ből, és a vírusok RNS-je lehet egyszálú vagy kétszálú. Ebben az esetben a külföldi (vírusos) mRNS elvágásának folyamata ugyanúgy történik, mint a fent leírt módon, vagyis a RISC enzimkomplex aktiválásával. Azonban a nagyobb hatékonyság érdekében a növények és a rovarok egyedülálló módon fejlesztették ki az siRNS védőhatását. Az mRNS lánc csatlakozásával az siRNS-hely a DICER enzimkomplex segítségével először töltheti be a második mRNS-láncot, majd különböző helyeken boncolhatja le, így létrehozva a különböző "másodlagos" siRNS-eket. Ezek viszont a RISC-t alkotják, és az összes fázisban végzik el az mRNS-t, egészen a teljes megsemmisülésig. Az ilyen "másodlagos" molekulák nemcsak a vírus mRNS helyén kötődnek, amelyhez az "elsődleges" molekulát irányították, hanem más helyekre is, ami drámai módon növeli a sejtvédelem hatékonyságát.
Így növényekben és inferior állati organizmusokban az siRNS fontos kapcsolat egyfajta "intracelluláris immunitásban", amely lehetővé teszi, hogy felismerjük és gyorsan elpusztítjuk az idegen RNS-t. Abban az esetben, ha egy RNS-tartalmú vírus belép a sejtbe, egy ilyen védelmi rendszer nem teszi lehetővé a szaporodást. Ha a vírus DNS-t tartalmaz, az siRNS-rendszer megakadályozza, hogy virális fehérjéket termeljen (mivel az ehhez szükséges mRNS-t felismeri és vágja), és ennek a stratégiának köszönhetően lassítja a szervezetben való elterjedését.
Az emlősökben, ellentétben a rovarokkal és növényekkel, egy másik védelmi rendszer működik. Ha egy idegen RNS, amelynek hossza meghaladja a 30 bp értéket, az emlős "érett" (differenciált) sejtjébe esik. a sejt elindítja az interferon szintézisét. Interferon, amely kötődik a sejtfelszín specifikus receptorokhoz. képes stimulálni a gének egy egész csoportját a sejtben. Ennek eredményeképpen számos olyan enzim szintetizálódik a sejtben, amely gátolja a fehérjék szintézisét és lebontja a vírus RNS-t. Ezenkívül az interferon képes a szomszédos, még nem fertőzött sejtekre hatni, ezáltal gátolja a vírus lehetséges terjedését.
Amint látja, mindkét rendszer sok tekintetben hasonlít: közös céljuk és a munka módszere. Még az "interferon" és "(RNS) interferenciák" is egy közös gyökérből származnak. De vannak még egy nagyon lényeges különbség: ha az interferon az első jele az invázió egyszerűen „befagyasztja” a sejtek működését, ami nem teszi lehetővé (csak abban az esetben), a termelés a számos, többek között az „ártatlan” fehérjék a sejtben, az siRNS rendszere eltér rendkívüli érthetőségét : az egyes siRNS csak saját, specifikus mRNS-t képes felismerni és elpusztítani. Az egyetlen nukleotidnak a siRNS-en belüli cseréje az interferenciahatás éles csökkenéséhez vezet. Az eddig ismert génblokkolók egyike sem tartalmaz ilyen kivételes specifikusságot a célgénjéhez képest.
Az RNS-beavatkozás felfedezése új reményt adott az AIDS és a rák elleni küzdelemben. Lehet, hogy a hagyományos antivirális terápiával együtt alkalmazva az siRNS-terápiát, egy potenciálhatást akkor lehet elérni, amikor két expozíció sokkal erőteljesebb gyógyhatást eredményez, mint az egyes alkalmazások egyszerű összege.
Az siRNS-interferencia mechanizmusának az emlős sejtekben való alkalmazásához már kész kétszálú siRNS-molekulákat kell bevezetni a sejtekbe. Az ilyen szintetikus siRNS optimális mérete 21-28 nukleotid. Ha hosszát növeli - a sejtek interferon termeléssel és a fehérjeszintézis csökkenésével reagálnak. A szintetikus siRNS-ek mind a fertőzött, mind az egészséges sejteket bejuthatják, és a nem fertőzött sejtekben a fehérje termelés csökkenése igen kívánatos. Másrészt, ha 21 nukleotidnál kevesebbet használunk, akkor a kívánt mRNS-hez való kötődés specifikussága és a RISC-komplex képződési képessége drasztikusan csökken.
Ha sikerül ilyen vagy olyan módon szállítani az siRNS, amely képes kötődni bármely részének a HIV genom (amely, mint tudjuk, RNS-ből áll), akkor próbálja megakadályozni annak a DNS-be a gazdasejt. Ezenkívül a tudósok olyan módokat fejlesztenek ki, amelyek befolyásolják a HIV-szaporodás különböző szakaszait egy már fertőzött sejtben. Az utóbbi megközelítés nem nyújt egy kúra, de akkor jelentősen csökkentik a vírus replikációt és így sarokba az immunrendszer egy esélyt, hogy „pihenni” egy vírus támadás, és a legtöbb próbálja meg kezelni a maradványai a betegséget. Az ábra a két szakasz a HIV szaporodás a sejtben, amely, mint a tudósok remélik, segítségével lehet reteszelni a siRNS, jelölt vörös kereszttel (4-5, lépések - a kromoszómába való integrációt a vírus, és a szakaszok 5-6 - a szerelvény a vírus és a sejtekből).
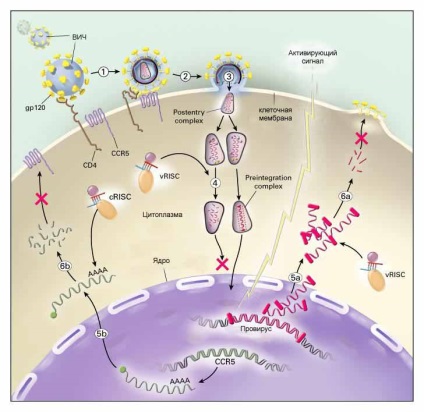
A fentiek mindeddig azonban csak az elmélet területére vonatkoznak. A gyakorlatban az siRNS-terápia nehézségekkel szembesül, amelyeket a tudósok nem tudnak megkerülni. Például vírusellenes terápia esetén az siRNS nagyfokú specifitása, amely kegyetlen viccet tud játszani: ismert, hogy a vírusok képesek gyorsan mutálni, azaz a vírusok gyorsan mutálódnak. megváltoztathatja nukleotidjainak összetételét. Különösen sikeres ebben a HIV-ben, amelynek változási gyakorisága olyan, hogy a vírus egyetlen altípusa által fertőzött személy néhány éven belül azonosítható altípussal azonosítható. Ebben az esetben a megváltozott HIV-törzs automatikusan érzékeny lesz a siRNS-re, amelyet a kezelés kezdetén választanak ki.
Öregedés és karcinogenezis

Mint minden epigenetikai faktor, az siRNA hatással van a gének kifejezésére, ami "csendes "vé teszi. Most vannak olyan munkák, amelyekben a tumorokkal kapcsolatos gének váltására vonatkozó kísérleteket írják le. A gének kikapcsolása (leütés) az siRNS alkalmazásával történik. Például, a kínai tudósok siRNS alkalmazásával kapcsolva gén transzkripciós faktor 4 (TCF4), amelynek aktivitása okoz Pitt-Hopkins szindróma (egy ritka genetikai betegség, amelyet a mentális retardáció és hiperventilációt és apnoés epizódok) és más mentális betegségek. Ebben a munkában tanulmányozták a TCF4 szerepét a gyomorrákban. A TCF4 ektopiás expressziója csökkenti a sejtszaporodást a gyomorrák sejtvonalaiban, és a TCR4-gént az siRNS-sel kiküszöböli a sejtmigrációt. Így, arra következtethetünk, hogy az epigenetikai off (elfojtó) TCF4 gén fontos szerepet játszik a kialakulását és fejlődését a daganatok.
Az Onkológiai Tanszéknek az Albert Einstein Rákközpontja, melyet Leonard H. Augenlicht vezetett, az siRNA részt vesz a HDAC4 gén leállításában. amely a vastagbélrák növekedésének gátlását, apoptózist és a p21 fokozott transzkripcióját gátolja. A HDAC4 egy hiszton deacetiláz, amely szövetspecifikus, elnyomja a sejtek differenciálódását és expresszióját a sejtek differenciálódási folyamata alatt elnyomják. A munka azt mutatja, hogy a HDAC4 a vastagbél-sejtek proliferációjának fontos szabályozója (ami a rákos folyamatban fontos), és ezt viszont az siRNS szabályozza.
A Patológiai Intézetben a japán Nara Orvosi Egyetem Orvosi Iskola prosztata-rákkutatást végzett. A replikatív sejtek öregedése akadályozza az ellenőrizetlen osztódást és a karcinogenezist. A rövid életű hasadó sejtek (TAC) a prosztata sejtpopuláció részét képezik, amelyből a daganat kialakul. A japán tudósok tanulmányozták az okokat, amelyek miatt ezek a sejtek leküzdik az öregedést. A prosztata sejtekben junB siRNS-t transzfektáltunk tenyészetben. Ezekben a sejtekben a p53, p21, p16 és pRb kifejeződése fokozott, az öregedéssel kimutatható. A tenyészetben a p16 csökkentett szintet mutató sejteket alkalmazzuk a következő lépésben. Az siRNS ismételt transzfekciója a TAC-ban lehetővé tette a sejtek számára, hogy elkerüljék az öregedést a p16 / pRb inaktiválásakor. Ezen túlmenően a proton-onkogén junB és a junB siRNA elcsendesedése a sejtek invázióját okozza. Ennek alapján azt a következtetést vonták le, hogy a junB a p16-nak a p16-nak a fokozója, és elősegíti a sejtek öregedését, ami megakadályozza a TAC rosszindulatúságát (malignitást). Így a junB a prosztata karcinogenezisének szabályozója, és célpont lehet a terápiás beavatkozásra. És tevékenysége szabályozható az siRNS segítségével.
Sok hasonló tanulmány létezik. Jelenleg az siRNA nem csak egy tárgy, hanem egy eszköz is egy kutató-orvos, biológus, onkológus, gerontológus kezében. A siRNS-nek az onkológiai megbetegedésekkel összefüggő asszociációjának vizsgálata, a korral társuló gének kifejeződése, a tudomány legfontosabb feladata. Az siRNS felfedezése óta nagyon rövid idő, és mennyi érdekes tanulmány és publikáció jelent meg számukra. Nem kétséges, hogy tanulmányuk az emberiség egyik lépése lesz a rák és az öregedés győzelmének.