Az atomok elektronállapota 1
4. Spin kvantumszám. (ms), nem kapcsolódik az atomos pályák jellemzőjéhez, hanem feltételesen jellemzi az elektron saját tengelye körül forgó forgását; csak két értéket vehet fel: +1 / 2 és -1 / 2, amelyek egymástól különböznek, valamint a többi kvantumszám értékeit egyenként.
Az első három kvantumszám jellemzi azt a pályát, amelyen az adott elektron található; a negyedik kvantumszám jellemzi egy adott elektron irányát egy adott pályán.
Az elektron állapotának általános jellemzőjét egy többelektron atomra az 1925-ben Wolfgang Pauli (1900-1958) által megfogalmazott elv irányítja.
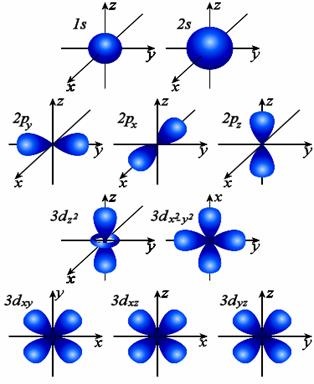
Ábra. 1. Formák és tájékozódás az 1s, 2s, 2p és a 3d orbitális elektronfelhők térben
egy atomban nem lehet két elektron azonos kvantumszámmal.
Ez azt jelenti, hogy nem lehet több, mint két elektron egy orbitálison, amelyet három kvantumszám jellemez. Két, ugyanazon az orbitális helyen elhelyezkedő elektronok különböznek egymástól a spin kvantumszám, azaz a spin kvantumszám értékei. ellentétes, vagy párhuzamos, pörgetésekkel jellemezhető, és párosítva vannak. Az ilyen orbitálisan elhelyezkedő ilyen elektronpárt vázlatosan ábrázolják az ellenkező irányú nyilak, míg egyetlen pár, azaz egy pár. A párosítatlan elektronot egy nyíl mutatja egy orbitálison.
Az atomban lévő elektron általában a legalacsonyabb energia tartalékkal rendelkezik.
Egy atom helyének energiaelőnyét a Klechkovsky-szabály határozhatja meg:
energetikai előnye által meghatározott térben a legkisebb összeg a fő és az oldalsó kvantum számok (n + l), ha ez az összeg azonos, az elektronok tele vannak kevesebb sublevels n.
A Klechkovsky-szabálytól kezdve az elektronok a következő sorrendben töltik ki az alsóbb szinteket:
1s 2 2s 2 2p 6 3s 3p 2 6 2 4s 3d 4p 10 6 2 4d 10 5s 5p 6S 2 4f 6 5d 14 10 6 6p 7s 2 5f 6d 14 10 14 6f 7P 6
Példa 12. Írja le az atom 18 Ar képlet elektronikus képletét. Határozza meg a szintek számát, alsó szintjeit, valence elektronokat.
Írja le: az atom elektronikus képletét 18 Ar
1.Iskhodya Aufbau elve elektronok kitölti sublevels a következő sorrendben: 1s 2s 2 2 2 2p 6 3s 3P 6 (e képletben Ar atomok).
2. Az Ar-3 atom szintjeinek száma.
3. Az Ar-atom szubsztitúsai (s, p).
elektronok száma 18 Ar 1s 2 2s 2 2p 6 3s 2 3p 6. Valence elektronok: 3s 2 3p 6.
Válasz: Az elektronikus képlet 18 Ar 1s 2 2s 2 2p 6 3s 2 3p 6. az Ar-3 atom szintjeinek száma; s-, p-alépítmények, valence-elektronok: 3s 2 3p 6.
Az orbitális kitöltése elektronokkal egy alsórés alatt történik a Gund szabályai szerint.
Gund első szabálya. Ebben a szintben az elektronok általában úgy töltik fel az energiaállapotokat, hogy a teljes spin maximális.
Gund második szabálya. A minimális állapot a mágneses kvantumszámok maximális összegével rendelkező állapot.
A kémiai kötést úgy értjük, mint a különböző típusú kölcsönhatások, amelyek meghatározzák a két- és poliatomikus vegyületek stabilitását: molekulákat, ionokat, kristályos anyagokat és más anyagokat.
Egy kémiai kötést, amelyet az atomok két elektron szimulálásával alakítanak ki, kovalens kötésnek nevezik.
A kémiai kötések leírására a mai napig a legszélesebb körben alkalmazzák az egyszerűsített empirikus módszereket, a Valence kötés módszerét (MBC) és a molekuláris orbitális módszereket (MMO). Ezek a módszerek a kvantummechanika fogalmán alapulnak.
MBC feltételezi. hogy az atomok közötti kölcsönhatás csak a párosítatlan elektronok miatt valósul meg.
Az AIM főbb rendelkezései:
a) a két atom közötti kémiai kötés az AO-nak az elektronpárok kialakulásával való átfedése következtében keletkezik;
b) atomok kötnek kémiai kötés között egymás között elektronok, amelyek a kötő párok. Az atomok közötti elektroncserék energiája (az atomok vonzerejének energiája) főleg hozzájárul a kémiai kötés energiájához. A kötési energia további hozzájárulását a részecskék Coulomb kölcsönhatási erői biztosítják;
c) a Pauli-elvnek megfelelően csak akkor keletkezik kémiai kötés, ha az elektronok kölcsönhatásba lépnek az antiparallel pörgetéssel;
d) a kémiai kötés jellemzői (energia, hossz, polaritás stb.) az átfedő AO típusa határozza meg.
Általános elektronikus párok alakíthatók ki:
a) a csere mechanizmussal;
b) a donor-elfogadó mechanizmuson.
Cserélő mechanizmus - egy közös elektronikus párt alkotnak a kölcsönhatásba lépő atomok páratlan elektronjaiból.
Így a H2 molekulák kialakulása. Cl2 a következőképpen ábrázolható:
1. reakcióvázlat: H2 molekulák elektronikus áramkörei. Cl2
Amikor elektronpárok képződnek, az elektronok száma a külső rétegben megnő mindkét atom esetében.
Egyszerűbb és vizuálisabb felvételhez valence áramköröket használnak. amelyben minden közös elektronikus párt egy kötőjel jelöli.
Ha egy molekula kialakításakor csak a kötésképződés csere mechanizmust alkalmazzuk, akkor a valencia séma egyforma a vegyület szerkezeti képletével.
Donor-akceptor mechanizmus - a kötés az egyik atom elektronpárjának és a másik szabad orbitálisának köszönhető.
Így az elem teljes kivalenciája megegyezik a páratlan elektronok (csere mechanizmus) és a donor-akceptor mechanizmus által létrehozott kötések számával.
Az elektronikus felhők átfedésének jellegétől függően, # 963; - (sigma -), π - (pi-) és # 948; - (delta) kapcsolatok (2.
Sigma-kötés (# 963;) -csatlakozás. melyeket átfedő AO képez a kölcsönható atomok magjait összekötő vonal mentén (3.
# 963; -bond fordulhat elő, amikor átfedés s pályák, s- és p pályák, p pályák, d pályák, d - és s pályák, d- és p pályák és f pályák egymást, és amikor a hibrid pályákat átfedik.
Az átfedő d-orbitálisok mind a négy lebeny által létrehozott összeköttetését nevezik # 948; (5. ábra).
5. ábra: Az atomikus d-orbitálisok átfedésének irányai,
Kovalens kötési tulajdonságok
1. A kovalens kötés iránya. A kommunikáció irányát a JSC hibridizációs típus határozza meg. A kovalens kötések kialakulásánál nemcsak "tiszta" atomsugárzókat (AO) feltételeznek, hanem "vegyes", úgynevezett hibrid AO-k is. A hibridizáció során az orbitálisok (elektron-felhők) eredeti formája és energiája kölcsönösen megváltozik, és új, azonos alakú és egyenlő energiájú orbitális (felhők) keletkeznek. A hibrid pályák száma (q) megegyezik a kezdeti pályák számával. Az AB típusú molekulák szerkezete a hibridizáció típusától függően a táblázatban látható. 6.
Ha egy s- és egy p-orbitális (sp-hibridizáció) részt vesz a hibridizációban, akkor két ekvivalens sp-orbitál keletkezik; Egy s- és két p-orbitálisból (sp2-hibridizáció) három sp2-orbitális keletkezik, és így tovább.
Az ilyen típusú hibridizációnak megfelelő hibrid felhők az atomban helyezkednek el, így az elektronok közötti kölcsönhatás minimális, azaz amennyire csak lehetséges. Ezért a sp-hibridizációs elektronfelhők ellentétes irányúak. Amikor SP 2 -hybridization - irányokba fekvő egy síkban, és alkotó együtt egy 120 ° -os szögben (vagyis irányokban felé tetejét az egyenlő oldalú háromszög) a sp3 -hybridization - a csúcsok egy tetraéder (a szög ezen irányok között van 109 ° 28 „), azzal sp3 hibridizációs d 2 - a csúcsok egy oktaéder (azaz mentén egymásra merőleges irányban).
A kvantitatív orientáció a molekulák és a szilárd anyagok kémiai kötésének irányai közötti valenciaszögek formájában fejeződik ki.
2. A kovalens kötés telítettségét a külső héjakon lévő elektronok számának korlátozása okozza, amelyek részt vehetnek a kovalens kötésben. Például a hidrogénnek 1 elektronja van, tehát egy kötés. Ezért a H2 lehetséges. de nem H3.
3. A kovalens kötés polaritása. Ha a kovalens kötést azonos atomok alkotják, például H-H, O = O, Cl-Cl, N N, akkor az elektron által megosztott elektronok egyenletesen oszlanak el közöttük.
Az ilyen kapcsolatot kovalens nempoláris kötésnek nevezik. Ha az egyik atom erősebben vonzza az elektronokat, akkor az elektronpár ezen atom felé mozog. Ebben az esetben poláris kovalens kötés keletkezik.
Az elektronspárnak az atommagok egyikére való elmozdulása következtében a negatív töltés sűrűsége egy adott atomon nő, és ennek megfelelően az atom töltést kap, amelyet az atom # 948; -. A második atom növeli a pozitív töltés sűrűségét # 948; +.
Az elektronok eltolódása és a kötés polaritása nagyobb, annál nagyobb a különbség az egymással kölcsönhatásban lévő elemek elektronegativitásában.