Az atom szerkezete
Az atom egy elektromosan semleges rendszer, amely pozitív töltésű magból és negatív töltésű elektronokból áll.
Az atommagok kétféle részecskéből (nukleonok) - protonokból (p) és neutronokból (n) állnak. A protontöltet nagyságrenddel egyenlő, és ellentétes az elektronikus töltéshez; tömege körülbelül egy amu. Neutron - egy töltetlen részecske, amelynek tömege megközelítőleg megegyezik a proton tömegével.
Az atom-
Összefoglalás atom tömege koncentrálódik a mag és jellemzi tömegszáma A, egyenlő a számok összege a protonok (magvaiban töltés) Z és neutronok N: A = Z + N.
Az atom fő jellemzője a (Z) sejtmag töltése. Meghatározza az elektronok számát a mag körül, azaz. egy atomnak egy adott kémiai elemhez való hozzárendelése, és megfelel egy atomszámnak (az elemek periódusos rendszerében - az ordinális szám).
Az elem atomjának kijelölésekor például a tömegszám és a protonok száma tükröződik.
Egy elem relatív atomtömege a természetes izotópok tömegének átlagértéke, figyelembe véve a szaporodás mértékét. Például a természetben lévő klór elsősorban két izotóp formájában van jelen - (75,43%) és (24,57%). A klór relatív atomtömege.
Az atom szerkezetének modern elméletének alapja a kvantum (hullám) mechanika törvényei és pozíciói, a fizikai ág, amely tanulmányozza a mikroobjektumok mozgását.
A mikroobjektumok mind a korpuszkuláris, mind a hullám tulajdonságait tartalmazzák. A mikrorészecskék mozgásának leírására egy probabilisztikus megközelítést alkalmaznak, azaz nem a pontos pozíciójukat határozzák meg, hanem annak valószínűségét, hogy egy közel nukleáris területet találunk ebben a régióban.
Egy atom elektronállapotát egy kvantummechanikai modell - egy elektronfelhő segítségével írja le, amelynek megfelelő részei sűrűsége arányos az elektronkeresés valószínűségével. Általában egy elektronfelhő úgy értendő, mint egy közeli nukleáris tér, amely az elektronfelhő kb. 90% -át fedezi. Ezt az űrrégiót is nevezik az orbitálisnak.
Van olyan kvantumszámrendszer, amely meghatározza egy atom elektronállapotát.
A fő kvantumszám határozza meg az elektron energiát és az elektronfelhő méretét. Integrált értékeket vehet fel 1-től.
Az elektronikus állapotok halmaza, amelyek azonos értékűek az n fő kvantumszámmal. az elektronréteg vagy az energia szintje.
Az E energia legkisebb értéke n = 1. A fennmaradó kvantumállapotok magasabb energiaértékeknek felelnek meg. Az ezen energiaszinteken lévő elektronok kevésbé szorosan kapcsolódnak a maghoz.
Hidrogénatom esetén az n = 1-es kvantumállapot megfelel a legalacsonyabb energiának, és alapállapotnak nevezik. Az n = 2, 3, 4 állapotokat gerjesztett állapotnak nevezik.
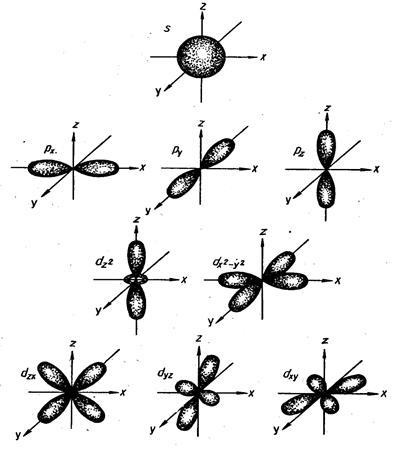
Az orbitális (közvetett) kvantumszám határozza meg az elektron orbitális szögletes impulzusát és jellemzi az elektronfelhő alakját. Minden egész szám 0-tól (n -1-ig). Minden n egy bizonyos számú értéknek felel meg, vagyis az energia szint olyan energiaszintek, amelyek kis mértékben különböznek az energiában. Az alsó szintek száma, amelyeken az energia szint megoszlik, egyenlő a szintszámmal (vagyis az n számértékével). Ezek az alsóbb szintek a következő betűjelekkel rendelkeznek:
Orbitális kvantumszám: 0 1 2 3 4
Alréteg: s p d f g
A különböző értékekhez tartozó orbitális formák a következő ábrán láthatók:
Időszakos törvény, nyitott DI Mendelejev 1869-ben a modern megfogalmazásban:
a kémiai elemek tulajdonságai, valamint az általuk alkotott vegyületek formái és tulajdonságai rendszeres időközönként függenek atomjaik magjainak töltés nagyságától.
magtöltés (a protonok száma) egyenlő a atomszáma az elem határozza meg, az elektronok száma az atom és, következésképpen, az elektron héj szerkezete az alapállapotú.
Az időszakos törvény grafikus ábrázolása az elemek periódusos tábla tábla. A kép formái eltérőek.
A táblák felépítésének elvi megközelítése egy - az elemek az atomok magjainak növekvő töltetének sorrendjében vannak elrendezve. Az elemek periodikus rendszerének fizikai alapja az atomok elektronikus konfigurációinak egy bizonyos sorrendje, a Z-elem sorozatszámának növekedésével.
Attól függően, hogy melyik energiaigényt töltik utolsó elektronokkal, négyféle elemet különböztetünk meg:
1. s-elemek - ez utóbbi a külső energiaszint s-alsóbevételével van kitöltve;
2. p-elemek - a külső energia alsó szintjének p-alsóvonala;
3. d - elemek - az utolsó előtti energiaszintek d-alsó szintje.
4. f-elemek - a harmadik szint f-alsóvonala a szinten kívül.
A hasonló energiatartalmú hasonló energiájú elektronok (hasonló alsó szintekkel töltött elemek) szintén hasonló kémiai tulajdonságokkal rendelkeznek.
Az időszak olyan elemek sorozata, amelyek elektronikus energiaméret-konfigurációja az ns1-ről az ns2np6-ra változik (az első időszakban s1 és s2). Ebben az esetben az időszak száma megegyezik a fő kvantumszám és a külső energia szint értékével.
Minden egyes időszak (kivéve az első) kezdődik és végződik egy tipikus fém nemesgáz, amely előtt egy nem-fém, azaz növekvő töltési periódus nucleus atomok, fokozatos változását tulajdonságok a fém jellemzően nem fémes, amely kötődik, hogy növelje az elektronok száma a külső energia szintet.
Az első három periódus s- és p-elemeket hoz létre. A negyedik és az azt követő elemek olyan elemeket is tartalmaznak, amelyekben a megfelelő belső energia szintek d- és f-albusztjait kitöltik. Az f-elemeket családokká alakítják, úgynevezett lantanidok (4f-elemek) és actinidek (5f-elemek).
A függőleges oszlopok, amelyeket csoportoknak neveznek, olyan elemeket kombinálnak, amelyek hasonló elektronikus struktúrával rendelkeznek. A táblázat rövid időtartamú változatában mindössze 8 csoport van, amelyek mindegyike fő és alcsoportokból áll. A elemei a fő alcsoportok az utolsó megtöltött S- és p- sublevels külső energia szintek, elektronszerkezet amelyek a fő tényező, ami meghatározza a kémiai tulajdonságainak elemek. Az al-alcsoportok elemei belső (n-1) d- és (n-2) f-albuszt tartalmaznak, amelyek külső energia szintjén 1-2 elektronot tartalmaznak.
Az analóg elemek ugyanolyan struktúrával rendelkeznek az atomok külső elektronhéjaival, mint az n fő kvantumszám különböző értékei, és ezért hasonló kémiai tulajdonságokkal rendelkeznek.
Így az atommagok töltéseinek egymást követő növekedésével az elektronhéjak konfigurációját rendszeresen megismételjük, és ennek következtében az elemek kémiai tulajdonságait rendszeresen megismételjük. Ez az időszakos törvény fizikai jelentése.
A fő és az alcsoportok elemei kémiai tulajdonságaikban különböznek egymástól, ám azok inherensek és közösek, amelyek egy csoportba egyesítik őket - a csoport számát. Ez rendszerint olyan vegyi anyagok számát jelöli, amelyek részt vehetnek a kémiai kötések kialakításában. Ez a csoport számának fizikai jelentése.
Így a fő elemeit alcsoportok valens (azaz részt vesz a kialakított kémiai kötésen) olyan külső elektron energia szinten, míg az oldalsó elemeit alcsoportok - és elektronok utolsó előtti szintet. Ez a fő különbség a fő és a másodlagos alcsoportok elemei között.
Mivel a kémiai elemek atomjainak elektronikus konfigurációja időszakosan változik a magjainak töltésének növekedésével, az elektronikus szerkezet által meghatározott tulajdonságok rendszeresen változnak az időszakos rendszer periódusaiban és csoportjaiban. Ezek a tulajdonságok elsősorban a különböző kémiai és fizikai tulajdonságai az elemek :. Atomic és ionos sugara, az elektron affinitás, az oxidáció mértékét atomi térfogat stb Rendszeresen változhat is számos kémiai és fizikai tulajdonságait, egyszerű és komplex vegyületek által alkotott elemek analógok.
Az atomnak nincs szigorúan meghatározott határa, ezért lehetetlen megállapítani abszolút dimenzióit. A következő atomok sugarait különböztetjük meg.
A kovalens sugár a megfelelő egyszerű anyagok molekuláiban vagy kristályaiban a belső mag távolságának fele.
A fémsugár a fém kristályrács két szomszédos atomjának középpontjainak fele közötti távolság.
Ezenkívül megkülönböztetik a kationok ionos sugarát. amelyek mindig kisebbek, mint a megfelelő elemek atom sugarai és az anionok sugarai. amelyek nagyobbak, mint az atom sugarak.
Az orbitális sugár az elméletileg számított távolság a magtól a fő pályák elektronterének fő maximumáig.
Az elemrendszerben figyelembe vett paraméterek változásának szabályossága időszakos jellegű. A leggyakoribbak a következők:
1. az atommagok csökkenése a növekvő nukleáris töltésű időszakokban;
2. A nukleáris töltés növekedésével rendelkező csoportokban az atomok sugara megnövekszik, míg az A csoportban ez a növekedés nagyobb mértékben megy végbe, mint a B csoportokban.
Egy elem kémiai aktivitását az atomok azon képessége határozza meg, hogy elveszítik vagy megszerezzék az elektronokat. Mennyiségi értelemben ezt az atomok ionizációs energiája Euon (vagy ionizációs potenciálja I) és az elektron Ec iránti affinitásának becslése alapján becsülik.
Az ionizációs energia a legkevésbé energia, amely a leggyengébben kötött elektron eltávolításához szükséges a nem kimért atomról (e-elem):
Az ionizációs energiát kilóól / mol (kJ / mol) vagy elektronvolt atomonként (eV / at) fejezzük ki.
Az elektronmező legkisebb feszültségét, amelynél az elektron leválik, I ionizációs potenciálnak nevezzük (B-ben kifejezve). Az I in volt számszerű értéke megegyezik az Euon ionizációs energiával. elektronvolumokban.
Az első elektron leválasztása megfelel az első I1 ionizációs potenciálnak, a második I2 ionizálásnak stb. Továbbá I1 Az ionizációs potenciál az atom néhány tulajdonságának komplex funkciója: a mag feltöltése, az atom sugara, a külső elektronhéjak konfigurációja. Az atom azon képessége, hogy negatív töltésű ionokat képez, egy elektron iránti affinitást mutat. ami azt jelenti, hogy az elektront egy semleges atomhoz kapcsolják az eljárás folyamán: Az elektron iránti legnagyobb affinitást a VIIA csoport elemei jellemzik. A legtöbb fém és nemes gáz esetében az elektron iránti affinitás kicsi vagy negatív. Két vagy több elektron hozzáadása az atomhoz egyáltalán nem lehetséges. Az elektronegativitás egy feltételes érték, amely az atom egy kémiai vegyületben való képességét jellemzi, hogy magához vonzza az elektronokat. Az elektronágosság (EO) gyakorlati viszonylagos besorolása bevezetésre került egy atom ilyen képességének gyakorlati értékeléséhez. Ilyen skála szerint a kémiai vegyületek kialakítására képes elemek közül a legelektronegatívabb a fluor, és a legkevésbé elektronegatív Franciaország. Az elem rendszáma növekvő időszakában az EO nő, és a csoportban általában csökken.Kapcsolódó cikkek