Laba a kémia №1
Célkitűzés: Meghatározni egy fém egyenértékét egy értékelési módszer alkalmazásával.
Rövid elméleti rész:
Az elemek kölcsönhatásba lépnek egymással szigorúan meghatározott mennyiségi viszonyokban. Az ekvivalensek törvénye szerint, amikor a molekulák elemekből vannak kialakítva, egymáshoz kapcsolódnak a vegyi ekvivalensek tömegével arányos tömegek.
Az ekvivalens egy anyag feltételes részecske, amely egy savas bázisos reakcióban egyenértékű egy hidrogénionnal vagy egy elektronon végzett oxidációs redukciós reakcióban.
A kémiai egyenértéket úgy is nevezik, hogy mennyisége, amely 1 mól hidrogénatomhoz kapcsolódik, vagy ugyanazt a hidrogénatomot helyettesíti kémiai reakciókban.
Az ekvivalens ekvivalens tömeg vagy móltömeg 1 mól ekvivalens tömege [g / mol], E = A / B, ahol A jelentése az elem moláris tömege, B az elem sztöchiometriai valenciája.
Egy komplex anyag olyan ekvivalense, amely egy ekvivalens hidrogénnel vagy egy ekvivalens bármely más anyaggal kölcsönhatás nélkül marad.
Az ekvivalens hidrogén tömeg 1,008 g / mol, mivel a molekulában lévő atomok mindegyike kölcsönhatásba lép egy hidrogénatomtal.
A sav ekvivalens tömege megegyezik annak moláris tömegével és a sav bázikusságával. A bázis ekvivalens tömege megegyezik a móltömegével, osztva a bázist alkotó fém vegyértékével. A só ekvivalens tömege megegyezik a móltömegével, amelyet a molekula molekuláinak atomjainak számával osztanak fel a fém vegyértékével.
Egy elem ekvivalense kimutatható kémiailag - a hozzáadandó (kicserélt) hidrogén (ek) vagy oxigén vagy bármely más elem, a megfelelő ekvivalens mennyiségének meghatározásával. Ezenkívül a megfelelő egyenértéket a Faraday-törvény alapján elektrokémiai úton is meghatározhatjuk, amely szerint ha 96484 sejt villamos energia áthalad az elektrolit oldaton, 1 ekvivalens anyag szabadul fel.
A dolgozat feladata az egyenértékű magnézium tömegének meghatározása az ekvivalensek törvénye szerint:
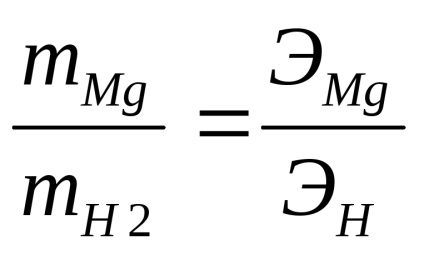
Lehetőség van feltételezni, hogy a kísérleti körülmények között az ideális gázállapot egyenlete (Mendeleev-Clapeyron-egyenlet) alkalmazható:
P a gáznyomás,
m az anyag tömege,
M a moláris tömeg,
T az abszolút hőmérséklet,
R = 8,315 J / K · mol az univerzális gázállandó.