A magnézium ekvivalens tömegének meghatározása
A kémiai ekvivalens olyan mennyiség, amely 1 mól hidrogénatomot tartalmaz, vagy azonos kémiai reakciókban helyettesíti az azonos számú hidrogénatomot. Például HCl, H2S, NH3. CH4 egyenérték klór, kén, nitrogén, szén 1 mol, 1 mol, 1/3 mol, 1/4 mol.
Az ekvivalens tömeg az anyag 1 ekvivalens tömege (g / mol). A fenti példákban a klór, kén, nitrogén és szén ekvivalens tömege 35,45 g / mol, 32/2 = 16 g / mol, 14/3 = 4,67 g / mol, 12/4 = 3 g / mol .
Egy elem ekvivalens tömegének értékét az alábbi egyenlet határozza meg:
E az elem ekvivalens tömege;
A az elem atomtömege;
B az adott vegyületben levő elem valenciája.
Például EA1 Al2O3-ban 27/3 = 9 g / mol; ECa CaSO4-ban 40,08 / 2 = 20,04 g / mol.
Az (1) egyenletből az következik, hogy az atom- vagy móltömegtől eltérően az ekvivalens tömeg nem konstans, hanem attól függ, hogy az elem mennyire hatásos. Az ekvivalens tömeg állandó értékei csak állandó valenciájú elemekre vonatkozhatnak.
Az ekvivalens tömegek és ekvivalensek fogalma komplex anyagokra terjed ki.
Egy komplex anyag egy egyenértéke annak a mennyisége, amely maradék nélkül egy ekvivalens hidrogénnel vagy egy ekvivalens bármely más anyaggal kölcsönhatásba lép.
Az anyag ekvivalens tömegét a móltömegéből számítják ki:
M a moláris tömeg.
A sav alapját a hidrogénatomok számával határozzák meg, amelyeket a savmolekula reagál a bázissal.
A bázis savasságát az alapmolekulához kapcsolódó protonok száma határozza meg, amikor kölcsönhatásba lép a savval.
Az elem ekvivalens tömegéhez hasonlóan a komplex anyag ekvivalens tömegének több értéke is lehet, attól függően, hogy melyik reakcióban vesz részt az anyagok.
Például a reakcióban:
A sav ekvivalens tömege megegyezik annak moláris tömegével:
Az egymással kölcsönhatásban álló anyagok tömege arányos az egyenértékű tömegükkel (ekvivalensek):
mA és mB az A és B kölcsönhatásban lévő anyagok tömege;
Az EA és az EB ezeknek az anyagoknak az egyenértékű tömege.
A (2) egyenlet az ekvivalensek törvényének matematikai kifejezése.
A papír célja a magnézium ekvivalens tömegének meghatározása. A kísérletet egy olyan berendezésen végezzük, amelynek rendszere az alábbi ábrán látható.
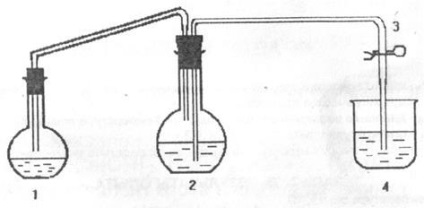
ahol 1 reakciópalack; 2 körös lapos fenekű lombik; 3 - bilincs; 4 - üveg.
TELJESÍTMÉNYI RENDELÉS
1. Mérjünk le 0,1 g magnéziumot a technikai mérlegeken, 0,01 g-n belül.
2. Szerelje össze a telepítést.
3. Öntsön kb. 25-30 ml-t a lombikba (1). hígított kénsav. Szárazra törölje a lombik nyakának belső falát szűrőpapírral.
4. Töltse fel a lombikot (2) a térfogat 3/4-ével vízzel, és zárja le egy dugóval a leeresztő csövekkel. Ha rövid csövön keresztül levegőt fúj, töltse fel a vizet hosszú csővel és szorítsa meg a bilincset (3). Győződjön meg arról, hogy a bilincs tartja.
5. Töltsön 50 cm3 vizet a főzőpohárba (4), és csavarja le a dugót az izzóból (2).
6. Tegye a lombikot (1) vízszintes helyzetbe és öntsük a magnézium felfüggesztett mennyiségét a nyak száraz falára (a fém nem kerülhet a savba!).
7. Zárja le a lombikot (1) egy dugóval egy rövid kisülőcsővel és lombikokkal (2). Zárja be óvatosan és gondosan. A lombikot tartsa a torok, a parafát gyengéden és fokozatosan le kell zárni, kissé elforgatva. (Vigyázni kell, hogy a magnézium bejusson az ACID-ba!).
8. Helyezze a lombikot (1) függőleges helyzetbe, egyidejűleg nyissa ki a kengyelt (3) és hagyja nyitva.
9. Tartsa be a magnézium kölcsönhatását savas és hidrogén vízkiszorítással az izzóból (2) a főzőpohárba 4.
10. Ha a magnézium teljes mértékben reagált a savval, szorítsa meg a bilincset (3), vegye le az elágazó csövet az üvegből (4), és mérje meg a hengerben levő vízmennyiséget a főzőpohárban.
11. A kapott térfogatból vonjunk le 50 cm3-t (vagyis azt a mennyiséget, amelyet a kísérlet előtt az üvegbe öntöttünk).
12. A különbség megegyezik a kivont hidrogén V1 térfogatával
1. Írja le a magnézium híg kénsavval való kölcsönhatásának reakciójára vonatkozó egyenletet.
2. A talált hidrogén (V1) térfogatát normál körülmények között a következő képlet segítségével hozzuk létre:
V0 a hidrogén mennyisége normál körülmények között, cm 3;
P - barometrikus nyomás, kPa;
P ≥ a telített vízgőznyomás a kísérleti hőmérsékleten, kPa;
T1 a kísérlet hőmérséklete, K. T1 = 273 + t.
3. Számolja ki az eltolódott hidrogén tömegét, határozza meg a magnézium ekvivalens tömegét.
Kísérleti hőmérséklet, ° C -
Barometrikus nyomás, kPa -
Magnézium-tömeg, g-
A telített vízgőz, kPa -
A hidrogén mennyisége a kísérleti körülmények között, cm 3 -
A hidrogén tömege, g -
A magnézium ekvivalens tömege, g / mol-
Telített vízgőznyomás különböző hőmérsékleteken
A térfogat szerint, normál hidrogénkörülmények között (V0) elmozdítva kiszámítja a térfogat tömegét. Tekintettel arra, hogy normál körülmények között (nu) a 22,4 literes hidrogén tömege 2 g tömegű, a H2 tömegét találjuk.
22,4 H2 súlya 2,0 g.
Az elfogyasztott magnézium (mMg) és az általa elhelyezett hidrogén ismert tömege szerint meghatározzuk a magnézium ekvivalens tömegét:
Az eredményt összehasonlítjuk a következő képlet segítségével számított egyenértékű tömeggel:
A a fém atomtömege; B a fém valenciája.
3. Mennyit nyerünk oxigént 3 g fém oxidálásával, amelynek egyenértékű tömege 9 g / mol.
4. Határozzuk meg a savak és bázisok egyenértékű súlyát:
5. Mennyi lesz n. egy ekvivalens oxigén és hidrogén tömege.
6. Határozzuk meg a fém ekvivalensét, ha 0,046 g mennyiséget választunk ki 62,35 ml H2 savból t = 17 ° C-on és 1,017 * 10 5 Pa nyomáson. A vízgőz nyomás 17 ° C-on 0,193 * 10 5 Pa.
7. Számítsa ki: a) az ón egyenértékű tömegét, ha az oxigénáramban 0,92 g-ot melegítenek, 1,17 g ón-oxid képződik;
b) magnézium, ha oxigénárammal melegítik, tömege 66,7% -kal nőtt.
8. A kénsav ekvivalensét a KOH-val való reakcióban számoljuk ki:
9. Számítsa ki a Ca (OH) 2 és a H3 PO4 ekvivalensét. Számítsd ki, hogy hány gramm Ca (OH) 2 szükséges 150 g H3 PO4 semlegesítésére
Laboratóriumi munka № 3