termodinamikai fázis
Termodinamikai termodinamikailag homogén fázist-részben a tulajdonságait a termodinamikai rendszer, elkülönül a többi érintkező felülete, amelyen bizonyos tulajdonságokat változik hirtelen rendszeren1.
A különböző fázisai egykomponensű rendszert lehet bemutatni különböző aggregált állapotok vagy különböző polimorf módosulatok egy anyag. A többkomponensű rendszer fázis lehet különböző összetételű és szerkezetű.
Gáz mindig áll egy egyfázisú fluid állhat több folyékony fázisok különböző összetételű, de két különböző folyadékok a készítmény nem egyidejűleg egyensúlyban létezik. Az anyag szilárd állapotban állhat több fázisból, amelyek közül néhány lehet ugyanolyan összetételű, de különböző struktúrák (polimorf módosulatait, allotrópia).
Fizikai állapotra halmazállapot jellemzi bizonyos minőségi tulajdonságokat - képes vagy nem képes fenntartani a térfogata és alakja, jelenléte vagy hiánya a hosszú távú és rövid távú rendezettséget, és mások.
Megváltoztatása halmazállapotát kíséri hirtelen változása a szabad energia, entrópia, sűrűsége és egyéb fizikai tulajdonságai a mag. Vannak alábbi állapotait aggregáció: szilárd test, folyadék, gáz, plazma.
Állítsa be a termodinamikai fázisok általában sokkal gazdagabb az aggregált állapotok, azaz ugyanabban az állapotban az anyag lehet a különböző termodinamikai fázisokat (jég, például, előfordul öt különböző változatban - fázisok). Ezért az ügy szempontjából leírt állapotok aggregációs inkább a durvaság, és ez nem tesz különbséget az egyes fizikai különböző helyzetekben.
Mindenesetre, a jelenléte a fázisátalakulás olyan elvi lehetőségük egy anyagot az egyik fázisból a másikba.
A fázisátmenet (fázisváltozás) termodinamikai - átmenet egy adott anyag egy olyan termodinamikai fázis egy másik a feltételek megváltoznak.
hőmérséklet, nyomás, vagy bármely más fizikai mennyiség, amelyben fázisátalakulások előforduló egykomponensű rendszer, az úgynevezett átmeneti pont.
Egy példa a fázis-NE passz lehetnek változások a halmazállapot az anyag vagy átmenetek kapcsolatos változások az összetétel, építeni-SRI és tulajdonságait az anyag (például, ne passz-kristályos anyag, OD távú módosításokat a többi).
Mivel a szétválasztás a termodinamikai fázis - finomabb osztályozás feltételek, mint a szétválás a halmazállapot az anyag, akkor nem minden fázisátalakulás kíséri változás halmazállapot. Azonban, bármilyen változás az aggregátum állapotban fázisátmenet.
Megkülönböztetni kétféle fázisátmenetek.
Fázis átmenet (például, kristályosodási, stb) kíséretében az abszorpciós vagy hőfelszabadulással, az úgynevezett hő egy fázisátalakulás.
Amikor az elsőrendű fázisátalakulás váratlanul megváltoztathatja a legfontosabb, széles körű elsődleges paraméterek: a fajlagos térfogat, a mennyiségű belső tárolt energia fel, a koncentráció a komponensek, stb ...
A leggyakoribb példák a fázisátalakulások: olvadási és kristályosodási, párolgás és kondenzáció, szublimációs és deszublimálási.
Fázisátalakulások jellemzi állandóságát hőmérséklet, a változás az entrópia és a hangerő. Ennek magyarázata az lehet adni a következő.
Under hopping anyagtulajdonságok értjük egy ugrás, ha a hőmérséklet és a nyomás. A valóságban azonban, hogy megváltoztatná a rendszer, akkor nem módosíthatja ezeket az értékeket, és a térfogata, és a teljes belső energia. Ez a változás minden esetben az egyes véges terjedési sebessége, ami azt jelenti, hogy ahhoz, hogy „fedezi” a teljes különbség a sűrűség, vagy fajlagos belső energia, szükségünk van egy véges ideig. Ez idő alatt, a fázisátalakulás nem történik egyszerre a teljes mennyiséget az anyag, hanem fokozatosan. Abban az esetben, elsőrendű fázisátalakulás van allokálva (vagy vett) egy bizonyos mennyiségű energiát, amely az úgynevezett látens hője fázisátmenet. Fokozatos átmenet nem állt, arra van szükség, folyamatosan kiszívja (vagy összeg) hővel vagy kompenzálják a végzett munka a rendszer.
Például, az olvasztással a test kell jelenteni, hogy egy bizonyos mennyiségű hő okoz a pusztítás a kristályrácsban. A betáplált hő az olvasztó a test nem jön, hogy a fűtési és a törés interatomi kötvények, így olvadási történik állandó hőmérsékleten. Ilyen átmenetek - egy rendezettebb kristályos állapotból egy kevésbé rendezett folyékony állapotban - a mértéke rendellenesség növekszik, és, a szempontból a termodinamika második törvényének, ez a folyamat növekedésével jár együtt a entrópia a rendszer. Ha egy átmenet bekövetkezik az ellenkező irányba (kristályosító), a rendszer kiemeli a meleget.
Fázisátalakulások non-abszorpció vagy felszabadulását hő és mennyisége változik, az úgynevezett fázisátalakulások a második fajta.
Ezek az átmenetek jellemzi állandóságát a térfogat és entrópia. A sűrűsége a belső energia is nem változik, úgy, hogy a szabad szemmel, mint egy fázis átmenet nem lesz látható. Ugrás is próbára deriváltak a hőmérséklet és nyomás: a fajhő, hőtágulási együttható, magas érzékenységet, stb ...
Általános kezelése fázisátalakulások II-O fajta által javasolt a szovjet tudós Landau (1908-1968). Ezen értelmezés szerint, a fázis II érdekében átmenetek kapcsolatos változások a szimmetria-RII: feletti átmeneti pont, a rendszer általában nagyobb szimmetriát, Ria, az alsó átmeneti pont.
A leggyakoribb példák a fázisátalakulások: a folyosón rendszer révén a kritikus pont, az átmeneti paramágneses vagy ferromágneses-paramágneses - antiferromagnet, átmeneti fémek és ötvözetek a szupravezető állapotban, az átmenet a folyékony hélium egy szuperfolyadék állapotban, átmenet amorf anyag üveges állapotú.
A modern fizika is vizsgálja rendszerek fázisátalakulások a harmadik vagy magasabb rendű. Nemrégiben széles körben elterjedt nézet egy kvantum fázisátalakulás, vagyis a fázisátmenet hajtja nem klasszikus termikus ingadozások és kvantum, hogy létezik még abszolút nulla hőmérsékleten.
Division fázisátalakulások két nemzetségek némileg önkényes, mivel vannak fázisátalakulások az első fajta kis ugrik a rendparaméter és a kis melegíti az átmenet erősen fejlett ingadozások. Ez a leginkább jellemző közötti átmenetek a folyékony kristályos fázisok.
Olvadás szilárd
Egy példa a elsőrendű átmenet az olvadási és kristályosodási szilárd anyagok. Olvadási folyamat fontos szerepet játszik a természetben (olvadó hó és jég a Föld felszínén, olvadó ásványok a belsejében, stb), és a szakterületen (termelés a fémek és ötvözetek, casting töltjük és mtsai.).
Plavlenie- test az átmenetet a kristályos szilárd anyagot a folyadék.
A főbb jellemzői a olvadó tiszta anyagokra van olvadási hőmérséklet (Tm) és hő (a fúziós hőt QPL) szükséges az olvadási folyamat.
A folyamat során a kristály olvadási hőmérséklet állandó marad. Ezt a hőmérsékletet nevezzük Tm olvadási. . Minden anyag saját olvadási hőmérséklete. Az olvadási hőmérséklet az adott anyag függ a légköri nyomást. A legmagasabb olvadáspontú közül tiszta fémek volfrám (3410 ° C), a legalacsonyabb -
higany (-38,9 ° C).
állandó hőmérsékleten annak a ténynek köszönhető, hogy olvadása a teljes hőterhelés rendezetlenné rendszeres térbeli elrendezése az atomok (molekulák) a kristályrácsban. A legtöbb kristályok (kivéve a vizet, és néhány ötvözetek), olvadási hőmérséklet növekedésével nő a külső nyomás, mivel az atomok elhatárolja egymástól magasabb nyomáson több energiát igényel, a termikus mozgások, t. E. A magasabb hőmérsékletet.
Az olvadt anyag nagy belső energia árrés, mint a szilárd állapotban. A fennmaradó részt a hőt olvadás fogyasztják munka elvégzésére, hogy a hangerőt a test alatt olvadó. Olvadáskor a mennyiség a legtöbb kristályos szilárd anyagban nő (3-6%), és csökkenti a megszilárdulás folyamán. De vannak olyan anyagok, amelyek az olvasztó térfogat csökken, és megszilárdulás közben - növekszik. Ezek közé tartozik, például, a víz, vas, szilícium és mások. Ezért a jég úszik a vízen, és a szilárd öntött - saját elolvad.
Olvadáspont akkor kezdődik, amikor a kristályos anyag Op. Elejétől a befejezése olvadási hőmérséklete az anyag állandó marad, és egyenlő a Tm anyag ellenére hő (ábra. 1). Hő kristály T> Tm normál körülmények között nem lehetséges, mivel jelentős túlhűtésével az olvadék elért viszonylag könnyen a kristályosítás során.
Olvadáspont történik a felszívódását a latens hő a fázisátalakulás - az olvadási hő QPL ..
Fajhője fúziós QPL. Ez azt mutatja, a hőmennyiség a teljes átalakuláshoz szükséges 1 kg anyag a szilárd, hogy a folyékony állapotban, időpontja az olvadási hőmérsékletet. QPL. = QPL. / M, J / kg.
Melting kíséri változások a fizikai tulajdonságai: növekedése entrópia, amely tükrözi a rendezetlen kristályszerkezete anyag; növeli a hőkapacitása, elektromos ellenállás. Falls, hogy szinte nullára olvadó nyírási ellenállása csökken a hangsebesség terjedési (longitudinális hullámok), stb
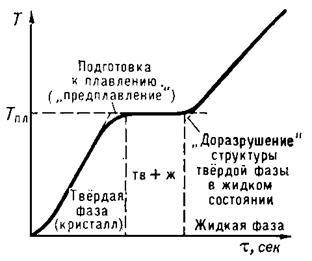
Ábra. 1. megállás olvadási hőmérséklete a kristályos test.
Az abszcisszán időt # 964;, arányos egyenletesen hordjuk fel a hőmennyiség a szervezetben.
Szerint molekuláris kinetikai ábrázolások, olvasztást a következőképpen végezzük. Amikor összefoglalja kristályos hőt a test növeli az energia rezgések (vibráció amplitúdója) annak atomok, amelyek növekedéséhez vezet a testhőmérséklet, és elősegíti a kialakulását a kristály különböző hibák (töltetlen kristályrácspontjaiban - helyzetben; rendellenességek periodicitása a rács atomok, beszivárgott közötti csomópontok, stb . a molekuláris kristályokat lehet részleges rendezetlenné kölcsönös tájékozódás a molekuláris tengelyek, amikor molekulák nem gömb alakja van. a fokozatos növekedése a hibák száma karakterizálni egyesület előolvasztás lépésben. elérésével Tm a kristályhibák létrehozott kritikus koncentráció kezdődik plavlenie- kristályrács bomlik le Áramló szubmikroszkopikus régióban. A betáplált hő az olvasztó a test nem jön, hogy a fűtési és a törés a interatomi kötvények és megsemmisítése hosszú rendezett tartomány kristályok. A magukat szubmikroszkópos területeken rövid hatótávolságú érdekében az az atomok elrendezése olvadása során nem változik jelentősen. Ez magyarázza az alacsonyabb értékek QPL fúziós hőt, mint a párolgási hő és a viszonylag kis változás számos fizikai tulajdonságait az hevítés során. Ahogy a hőmérséklet növekszik a molekulák mozognak egyre intenzívebb. Amikor fűtött, nem csak növeli a molekuláris kinetikus energia a test, hanem a potenciális energia annak atomok, mivel a növekvő amplitúdóval rezgések atomok távol egymástól nagyobb távolságban és egymáshoz közelítjük rövidebb távolságban, úgyhogy a kölcsönhatás energiája azok növekszik az elektromos töltés. Növekvő hőmérséklettel lép fel végre, mint az idő, amikor fenntartása érdekében között erősen lengő atomok lehetetlenné válik, és a pusztítás a kristályrács indul ezen a ponton, ami a fading és a hosszú távú rendezettséget. Egy szilárd olvadékok.
Amorf szilárd anyag idővel a hőmérséklet változás nem állandó hőmérsékletű része, és csak a inflexiós pontban. Növelése amorf testhőmérséklet kíséri folyamatos csökkenése annak viszkozitását.
Fordított átadása egy anyag szilárd állapotban is lehetséges mind a folyékony és gáznemű Államok. Ebben és a másik esetben egy átmenet bekövetkezik egy állami mentes szimmetria, az állam, ahol szimmetria létezik (ez vonatkozik a hosszú távú tartós rendezettségű, amely akkor a kristályok, és amelyben nem folyadékokat, sem gázok). Ezért, az átmenet a szilárd állapotban kell megtörténnie hirtelen egy bizonyos hőmérsékleten, szemben a folyadék-gőz átmenet, ami történhet folyamatosan. A folyamat kialakulásának egy szilárd testnek, hűtőfolyadékot egy olyan folyamat, a kristályképződés (kristályosító), és ez fordul elő egy bizonyos hőmérsékleten - kristályosodási hőmérsékletét. Mivel az ilyen átalakító rendszer, az energia csökken, ezt az átmenetet kell kísérnie az energia felszabadítását hő formájában kristályosodási. Az energiamegmaradás törvényének következik, hogy a fúziós hő és kristályosodási hőt egyenlőnek kell lennie egymással.