Elektronikus molekuláris szerkezete
Mindegyik molekula, egy ion vagy egy szabad gyökös, amelyek csak lokalizált elektronok e lehet képletű, úgynevezett Lewis olyan szerkezetet, amely megmutatja a lokalizáció elektronok. B egy Lewis-képletek azt mutatják, csak a vegyérték elektronok - köthetnek kovalens kötés vagy megosztása megszűnik. A következő általános szabályokat írásához használt Lewis szerkezetek:
1. A teljes száma vegyérték elektronok a molekulában (valamint ion vagy gyök) meg kell egyeznie az összessége a külső héj elektronok, a pozitív töltését plusz vagy mínusz esetében a negatív ionok.
2. osztatlan elektronok (vagy önmagában, vagy gőz) formájában részét csak a külső héj egy atom, és az elektronok résztvevő a kialakulása egy kovalens kötés, részét képezik a külső héj mindkét atomok. Atomjai elemei a második időszak nem lehet több, mint nyolc vegyérték elektronok (szabály oktett). Azokban az esetekben, ahol az épületszerkezetek lehetséges, a száma vegyérték elektronok az atomok vagy kevesebb, mint nyolc, vagy nyolc, valósul szerkezetek oktett elektronok, mert van egy kis energiát. Például, az etilén szerkezete
Az oxigén molekula kétvegyértékűség szerkezete alacsonyabb energiatartalmú, mint a szerkezet a kettős kötés, de ebben az esetben minden egyes oxigénatom van jelen, mint az elektron nyolc párosítatlan elektronok kerülnek ugyanaz mindkét atomav -MOD, azaz oktett szabály van tárolva.
3. Jellemzően hivatalos vádemelés pontot minden egyes atom. Feltételezzük, hogy az atom az összes párosítatlan elektronok, de csak a fele az elektronok részt a kialakulása egy kovalens kötés. A felesleges elektronok tartozó atom okoz negatív töltés, és a hiányzó - pozitív.
elektronegativitási
Electron felhő az atom összekötő két azonos, szimmetrikusan (tekintetében intermolekuláris kötést sík és elosztjuk azt a fele), minden más esetben, az elektronsűrűség inkább tolódik az egyiket. Ez egyfajta vonzás hívják elektronegativitási. Azt mondják, hogy az atom, amelyhez az elektronsűrűség van tolva, hogy nagyobb mértékben, több elektronegatív. Elektronegativitás atomok természetétől függ, a környezet és a hibridizáció. Vannak különböző mennyiségi jellemzőit elektronegativitási. A leghíresebb Pauling skála alapján kötési energiák kétatomos molekulák. A -B kötési energiát veszik, mint a számtani átlaga kötési energiája a molekulák és B -A -B. Az így kapott a relatív elektronegativitási. A szabványos take elektronegativitása elektronegatív elemek - fluor. Ebben a skála, fluoratom került tulajdonítják, hogy a elektronegativitási egyenlő 4. A elektronegativitása minden elem kapott különbség az igaz kötési energia A -B és a számtani középértéket értéke a kötési energiák az A és B -A -B általános képletű (a különbség jelölik ):
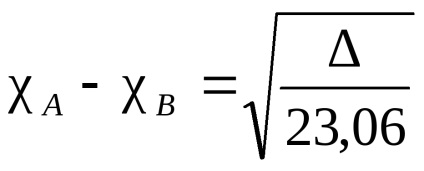
ahol
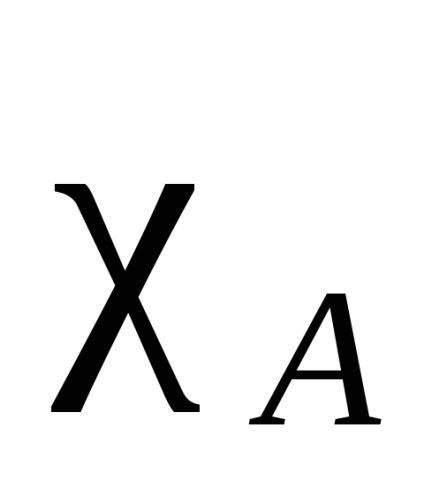
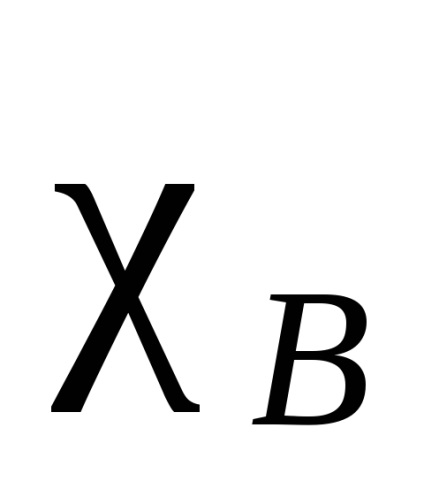
Más megközelítések különböző elveken alapuló. Ezek közül néhány megközelítések lehet kiszámítani a különböző elektronegativitása vegyérték-állapotú, különböző hibridizációkat (SP szénatom elektronegatívabb mint 2. sp amely viszont több, elektronegatív, mint SP 3), valamint a primer, szekunder és tercier szénatom. Továbbá, lehetőség van nemcsak kiszámításához electronegativities atomok, hanem a csoportok (1. táblázat).
1. táblázat Elektronegativitás szénatomot függően a környezetre és a hibridizáció.