A hő felhasználásának módját egyensúly egyenlet, a fizika
1. Az első főtétele és hő egyenlete
Eddig úgy az első főtétel alkalmazása a gázokat. A megkülönböztető jegye a gáz, hogy a térfogata jelentősen változhat. Ennélfogva, az első főtétel szállított földgáz mennyisége Q hő összegével egyenlő tökéletes munkagáznyomások és változások a belső energia:
Ebben a részben figyelembe vesszük az esetekben, amikor egy bizonyos mennyiségű hőt jelentett folyékony vagy szilárd. Ha hűtés vagy fűtés őket enyhén változhat a mennyiség, így tökéletes a tágulási munka általában elhanyagolt. Következésképpen folyadékok és szilárd anyagok első főtétele felírható
Az egyszerűség kedvéért ezt a egyenlet, azonban megtévesztő.
Az a tény, hogy a belső energia a test csak a teljes mozgási energia véletlenszerű mozgás alkotó részecskék csak akkor, ha ez a test egy tökéletes gáz. Ebben az esetben, mint láttuk, a belső energia egyenesen arányos az abszolút hőmérséklettel (§ 42). A folyadékok és a szilárd anyagot a nagy szerepet játszott a potenciális energiája közötti részecskéket. És ez a tapasztalat azt mutatja, akkor is megváltoztatható, állandó hőmérsékleten!
Például, ha a mennyisége a hőátadó jeges vizet, annak hőmérséklete állandó marad (egyenlő 0 ° C), amíg a jég el nem olvad. (. Ez az oka annak, hogy a hőmérséklet az olvadó jég és kapott egy időben, mint a referenciapont meghatározásakor a Celsius skála) Ez a bemenet hő fogy, hogy növelje a potenciális energia molekuláris kölcsönhatás: átalakulhat olyan folyadékkristályos, meg kell tölteni az energia a megsemmisítését a kristályrácsban.
Hasonló jelenség lép fel, majd a forrásponton, ha olyan mennyiségű hőátadó vízben a forrás hőmérsékletén, annak hőmérséklete állandó marad (egyenlő 100 ° C-on, normál légköri nyomáson), amíg a víz főtt ki. (Mert, és a kiválasztott, mint a második referencia pont a Celsius skála.) Ebben az esetben, a hőbevitel is fogyasztják, hogy növeljék a potenciális energia kölcsönhatása a molekulák.
Furcsának tűnhet, hogy a potenciális kölcsönhatás energiája a molekulák a pár nagyobb, mint a vízben. Végtére is, a gázmolekulák alig hatnak egymásra, így a potenciális energiája a kölcsönhatás természetesen figyelembe nulla szinten. És megérkezik. De aztán a potenciális kölcsönhatás energiája a molekulák a folyadék kell tekinteni negatív.
Egy ilyen megjelölés potenciális energia jellemző vonzza szervek. Ebben az esetben, hogy növelje a távolságot a szervek, meg kell csinálni a munkát, azaz, hogy növeljék a potenciális energiája a kölcsönhatás. És ha azután, hogy ez lesz egyenlő nullával, akkor még nem volt negatív.
Így az állapotváltozás folyadékok és szilárd anyagok kommunikál velük egy bizonyos mennyiségű hőt kell tekinteni, figyelembe véve annak lehetőségét, hogy változtatna a halmazállapotban. Változások a halmazállapotban hívják fázisátmenetek. Ez - konvertáló a szilárd test egy folyékony (olvadás), folyadékot egy szilárd (szilárdulási és kristályosodási), a folyadék gőzzé (párolgás) a folyadék és gőz (kondenzáció).
A törvény az energiamegmaradás a termikus jelenségek a folyadékok és szilárd anyagok, az úgynevezett egyenlet hő egyensúlyt.
Tekintsük először a hő egyenlete az esetben, ha a hőcsere végbemegy, a két szerv közötti, valamint a hőcserélő és más szervek is elhanyagolhatók (kísérletileg hogy olyan feltételeket teremtsünk használnak kaloriméter - konténerek, amelyek szigetelés a részletekért).
Tegyük fel (ahogy azt korábban gondolták, hogy gázok) által továbbított test hőmennyiség pozitív, ha az eredménye ez a belső energia a test növekszik, és negatív, ha a belső energiája csökken. Ebben az esetben a hő egyensúly egyenlet a következő alakú
ahol Q1 - átadott hőmennyiség, hogy az első test a második, és a Q2 - egy átadott hőmennyiség a második test az első.
Egyenlet (1) világos, hogy ha a test felmelegszik, a másik ad testét. Például, ha Q1> 0, Q2 <0.
Ha a hőcserélő között történik az N szervek, a hő egyensúly egyenlet formában van
2. A hő egyensúly egyenlet nélkül fázisátalakulások
Feltesszük, egységes testet, azaz állhatnak kizárólag egy anyag (például, egy bizonyos tömeget víz, acél vagy réz bár, és így tovább. D.). Tekintsük először azt az esetet, amikor az aggregációs állapotban a test nem változik, azaz, a fázisátalakulás megtörténjen.
Természetesen az általános iskola fizika tudja, hogy ebben az esetben továbbítja a test melege Q egyenesen arányos testtömeg m és a változás a hőmérséklet At:
Ebben a képletben, mind a Q, és At lehet pozitív és negatív értékeket.
Szerepel a képletben a értéke úgynevezett specifikus hő anyag, amelyből a test áll. Általában a problémák hőegyensúly alkalmazott egyenletet a hőmérséklet a Celsius skála. Így teszünk is.
1. ábra 48,1 ábra grafikon, a hőmérséklet a két test a átadott hőmennyiség nekik K. egyes Testtömeg 100 g
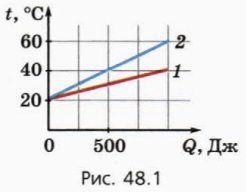
a) egy test fajhője nagyobb, és hányszor?
b) Mi a hőkapacitása minden test?
2. A kaloriméter, amely 150 g vízben 20 ° C-on, kiveszik a forró vizet merített fémhenger. Fajhője víz 4,2 kJ / (kg * K). Vegyük, hogy a hőveszteség elhanyagolható.
a) Magyarázza meg, miért tartja egyenlet
ahol a cm és CB - értékek a hőkapacitása a fém, illetve vízben um és MW - értékek a henger tömege, illetve vízben, tc - a végső értéke a kaloriméter tartalmának hőmérsékletét, amikor a termikus egyensúlyi állapot jön létre abban.
b) melyik a két kifejezés a fenti képletben pozitív, és néhány - a negatív? Indokolja válaszát.
c) Mi a fajhője a fémhenger, ha a tömege 100 g, és a végső hőmérséklet 25 ° C?
g) Mi a végső hőmérsékletet, ha a henger készül alumíniumból, tömege 100 g? A fajlagos hőkapacitása alumínium egyenlő 0,92 kJ / (kg * K).
d) Mi a tömege a hengerből, amikor ez történik, a réz és a végső hőmérséklet 27 ° C? A fajlagos hőkapacitása réz 0,4 kJ / (kg * K).
Vegyük azt az esetet, ha a mechanikus energia alakul a belső. J. angol fizikus. Joel megpróbálta mérni, hogy mennyi felmelegszik a víz a esik, amikor üti a földön.
3. Mi volt a magassága, a víz alá, hogy mikor éri el a talaj, a hőmérséklet emelkedett 1 ° C? Tegyük fel, hogy a belső energia, a víz lesz a fele a potenciális energia.
A válasz akkor miért tudósok nem sikerült. Tartsuk szem előtt, hogy a tapasztalat tudósai otthon, ahol a magasság a legmagasabb vízesés - mintegy 100 m.
Ha a testet melegíti az elektromos fűtés vagy a tüzelőanyag elégetése szükséges figyelembe venni a hatékonyság a fűtés. Például, ha a fűtőelem hatékonysága 60%, ez azt jelenti, hogy a növekedés a belső energia a fűtött test 60% -a hő égése során felszabaduló vagy dolgozó elektromos fűtés.
Emlékezzünk továbbá, hogy a tömeg m során az égési üzemanyag mennyiségét Q hő szabadul, amely általános képlete
ahol q - specifikus égéshő.
4. Hogy 3 liter vizet egy lombik hőmérsékletét 20 ° C-forrásig, Tour volna megégetik 3 kg száraz pálca. Mi a hatékonysága a tűz, mint egy melegítő? A fajlagos égéshője tűzifa fogadja egyenlő 107 J / kg.
5. A villamos fűtés próbál forraljuk 10 liter vizet, de a víz nem forraljuk: amikor a fűtőeszköz a hőmérséklet állandó marad 100 ° C alatti Fűtési teljesítmény 500 W, a hatékonysága 90%.
a) Mennyi hőt 1 vízzel a melegítő?
b) Mennyi hő átadódik az 1 vízzel a környező levegő, amikor a fűtő, amikor a víz hőmérséklete állandó?
c) Mennyi hőt ad vízben 1 percig környezeti levegő kikapcsolása után azonnal a fűtés? Vegyük figyelembe, hogy ez idő alatt a víz hőmérséklete nem változik jelentősen.
d) Ami a víz hőmérséklete csökken 1 percig kikapcsolása után azonnal a fűtés?
3. A hő egyensúly egyenlet jelenlétében fázisátalakulások
Idézzük néhány tény ismert meg a kurzus az általános iskola fizika.
Annak érdekében, hogy teljesen megolvad a kristályos szilárd anyag olvadási hőmérséklete, szükséges, hogy tájékoztassa őt a Q hőmennyiség, arányos a test tömege m:
Λ az úgynevezett együttható arányosság egyedi fúziós hője. Ez számszerűen egyenlő a hőmennyiség, amely szükséges, hogy tájékoztassa a kristályos test tömege 1 kg olvadási hőmérsékleten annak érdekében, hogy teljesen kapcsolja be a folyadék. Az egység specifikus fúziós hő 1 J / kg (joule per kilogramm).
Például, a fajhője olvadó jég 330 kJ / kg.
6. Milyen magasan lehetett emelni a személy 60 kg testtömegű, ha növeljük a potenciális energia összegével numerikusan a hőmennyiség, ami szükséges, hogy olvad 1 kg jég 0 ° C?
A problémák megoldása fontos megjegyezni, hogy a szilárd megolvad csak azt követően kerül minden felmelegítjük az olvadáspontja. Telken testhőmérséklet elleni átadott hőmennyiség, hogy ez által az olvasztási folyamat egy vízszintes szegmens.
7. ábra 48,2 ábrázolja egy grafikon a testhőmérséklet 1 kg az átadott hőmennyiség rá.
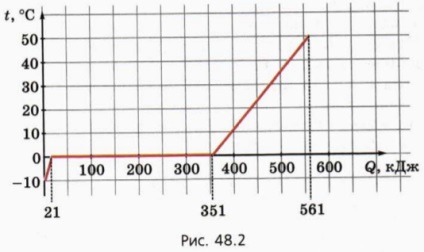
a) Mi a hőkapacitása a test szilárd állapotban?
b) Mi az olvadáspontja?
c) Mi a fajhője olvadó?
d) Mi a hőkapacitása a test folyékony állapotban?
d) hogy a test állhat bármilyen anyag?
8. A földi légkör belép Vasmeteorit. A fajlagos hőkapacitása vas 460 J / (kg * K), amelynek az olvadáspontja 1540 ° C, látens fúziós hője 270 kJ / kg. A kezdeti hőmérséklet, hogy meteor bejárata a légkörbe, hogy egyenlő -260 ° C-on Tegyük fel, hogy 80% -a a kinetikus energia a meteorit halad keresztül a légkörbe jut a belső energia.
a) Mi a legkisebb kezdeti sebesség meteorit, hogy felmelegedjen, hogy az olvadási hőmérsékletet?
b) Melyik részét a meteorit elolvad, ha a kezdeti sebessége 1,6 km / s?
Ha jelenlétében fázis átmeneti hőmérséklet szükséges, hogy megtalálják a férőhelyek száma a testek, először meg kell találni, hogy mi lesz a végső állapot. Például, ha a kezdeti állapot egy adott tömegű jég és víz és az értékek azok a hőmérsékleten, majd három lehetőség van.
A végső állapotban csak a jég (ez lehet, ha a kezdeti hőmérséklete a jég elegendően alacsony, vagy a tömege jég elég nagy). Ebben az esetben egy ismeretlen mennyiség a végső hőmérséklet a jég. Ha a probléma nem oldódott meg, a kapott érték kisebb, mint 0 ° C-on Amikor létrehozó termikus egyensúly, ez a jég melegítjük, a végső hőmérséklet, de az összes vizet lehűtjük 0 ° C-on, majd megfagy, és a jég ebből képződő hűtjük, a végső hőmérséklet (ha 0 ° C alatt).
A végső állapotban vannak a termikus egyensúlyban jég és víz. Ez csak akkor lehetséges hőmérsékleten 0 ° C-on Ismeretlen mennyiség ebben az esetben a végső tömege jég (vagy az utolsó víz tömege: az összeg tömeg víz és jég van megadva). Ha a probléma nem oldódott meg, a végső tömege jég és víz pozitív. Ebben az esetben, amikor létrehozó termikus egyensúly kezdetben melegíti a jéggel 0 ° C-on, és vízzel, majd lehűtjük 0 ° C-on Ezután, egy részét jég olvadása, vagy néhány a víz megfagy.
A végső állapot csak vizet. Ezután egy ismeretlen mennyiséget az a hőmérséklet (ez nem lehet alacsonyabb, mint 0 ° C-on), ebben az esetben a vizet lehűtjük, a végső hőmérséklet, és a jég, hogy menjen át egy bonyolultabb utat: először ő egész melegítjük 0 ° C, majd az egész olvadás, majd ezekből képzett víz felmelegítése a végső hőmérsékletet.
Annak megállapításához, hogy e lehetőség valósul meg egy adott feladat, szükséges, hogy némi kutatást.
9. A kaloriméter tartalmazó 1,5 liter vizet hőmérsékleten 20 ° C-on, hogy egy darab jég -10 ° C-on Vegyük, hogy a hőveszteség elhanyagolható. A fajhője jég 2,1 kJ / (kg * K).
a) Mi lehet a jégtömeg, ha a végső állapotban a kaloriméter csak jég? Ha a víz? jég és víz termikus egyensúlyban?
b) Mi a végső hőmérsékletet, ha a kezdeti tömege 40 kg jég?
c) Mi a végső hőmérsékletet, ha a kezdeti tömege 200 g jég?
g) Mi a végső tömeg víz, ha a kezdeti súly 1 kg jég?
Az a tény, hogy az olvadási szervezet szükséges tájékoztatni bizonyos mennyiségű hőt, ez a természetes. Ez a jelenség szolgált számunkra a jó helyette: lelassítja a hóolvadás, csökkentve az árvíz a tavasszal.
De az a tény, hogy a kristályosodás a test ad egy bizonyos mennyiségű hőt, lehet kivédeni: A víz ha megfagy tényleg ad egy bizonyos mennyiségű hőt? Mindazonáltal, ez így van: fagyasztás és fordult jeges vízbe ad egy meglehetősen nagy mennyiségű hőt, vagy hideg levegő a jég, ahol a hőmérséklet 0 ° C alatti Ez a jelenség is szolgált számunkra a jó helyett, puhító az első fagyok, és a tél beállta.
Mi most úgy a lehetőségét átalakítása folyadékpárolgási vagy gőz a folyadék.
Mint tudod honnan fizika persze általános iskola, a Q hőmennyiség, átalakításához szükséges a folyadék gőzzé állandó hőmérsékleten arányos az m tömegű folyadék:
Az arányossági tényező az úgynevezett L fajlagos hője. Ez számszerűen egyenlő a hő mennyiségét jelenteni kell 1 kg folyékony teljesen átalakítsuk azt gőzzel. Az egység specifikus párolgási hőt 1 J / kg.
Például, a látens hő párologtatás víz forrási hőmérsékleten, és atmoszférikus nyomású levegő körülbelül 2300 kJ / kg.
10. A kaloriméter, ahol vannak 1 liter vízben 20 ° C-on, beviszünk 100 g gőz hőmérsékleten 100 ° C-on Melyik lesz egyenlő a hőmérséklet a kaloriméter után termikus egyensúly? A hőveszteség elhanyagolható.
További kérdések és feladatok
11. A hő a lemezt egy bizonyos tömegű víz 20 ° C és az oldószer forráspontja, azt 6 min. Meddig, hogy az összes vizet forralnak el? Vegyük, hogy a hőveszteség elhanyagolható.
12. A kaloriméter tartalmazó 100 g jeget tömegű hőmérsékleten 0 ° C-on, vezetünk be gőzt hőmérsékleten 100 ° C-on Melyik egyenlő lesz a víz tömege a kaloriméter, amikor az összes jég elolvad, és a víz hőmérséklete lesz 0 ° C?
13. A felhevített alumínium kockát került egy lapos blokk a jég, a hőmérséklet 0 ° C-on Hány fokra felhevült kockát, ha teljesen elmerül a jég? Vegyük, hogy a hőveszteség elhanyagolható. A fajlagos hőkapacitása alumínium 0,92 kJ / (kg * K).
14. Ólom golyó üt egy acéllemezből és lepattanó azokból. Bullet hőmérsékletet 50 ° C-csapást sebessége 400 m / s. bullet megnyomása után sebessége 100 m / s. Mi része a lövedék elolvadt, ha a belső energia a golyók át 60% -a elveszett kinetikus energia? A fajlagos hőkapacitása ólom 0,13 kJ / (kg * K), amelynek olvadáspontja 327 ° C, a fajhője olvadása 25 kJ / kg.